13.4:
Determinação da Ordem de Reação
13.4:
Determinação da Ordem de Reação
As leis de velocidade descrevem a relação entre a velocidade de uma reação química e a concentração dos seus reagentes. Em uma lei de velocidade, a constante de velocidade k e as ordens de reação são determinadas experimentalmente observando como a velocidade de reação muda à medida que as concentrações dos reagentes são alteradas. Uma abordagem experimental comum para a determinação das leis de velocidade é o método das velocidades iniciais. Este método envolve a medição das velocidades de reação para ensaios experimentais múltiplos efetuados com diferentes concentrações iniciais de reagentes. A comparação das velocidades medidas para estes ensaios permite determinar as ordens de reação e, posteriormente, a constante da velocidade, que em conjunto são utilizadas para formular uma lei de velocidade.
A velocidade de uma reação, por exemplo, envolvendo óxido nítrico com ozono [NO (g) + O3 (g) ⟶ NO2 (g) + O2 (g)] pode ser determinada a partir dos dados experimentais do método das velocidades iniciais , no laboratório.
| Teste | [NO] (mol/L) | [O3] (mol/L) | Δ[NO2]/Δt (mol/L·s) |
| 1 | 1,00 × 10−6 | 3,00 × 10−6 | 6,60 × 10−5 |
| 2 | 1,00 × 10−6 | 6,00 × 10−6 | 1,32 × 10−4 |
| 3 | 1,00 × 10−6 | 9,00 × 10−6 | 1,98 × 10−4 |
| 4 | 2,00 × 10−6 | 9,00 × 10−6 | 3,96 × 10−4 |
| 5 | 3,00 × 10−6 | 9,00 × 10−6 | 5,94 × 10−4 |
A partir dos dados de velocidade, é formulada uma lei de velocidade genérica; velocidade = k[NO]m[O3]n. Os valores das ordens de reação m e n e da constante de velocidade k são determinados a partir dos dados experimentais, utilizando um processo de três passos:
No passo 1, o valor de m é determinado a partir dos dados onde [NO] varia e [O3] é constante. Nos testes 3, 4 e 5, [NO] varia enquanto que [O3] permanece constante. Quando [NO] duplica do teste 3 para o 4, a velocidade duplica, e quando [NO] triplica do teste 3 para o 5, a velocidade também triplica. Assim, a velocidade também é diretamente proporcional a [NO], e m na lei de velocidade é igual a 1.
No passo 2, o valor de n é determinado a partir dos dados onde [O3] varia e [NO] é constante. Nos testes 1,2 e 3, [NO] é constante e [O3] varia. A velocidade de reação muda na proporção direta à mudança de [O3]. Quando [O3] duplica do teste 1 para o 2, a velocidade duplica; quando [O3] triplica do teste 1 para o 3, o aumento da velocidade também triplica. Assim, a velocidade é diretamente proporcional a [O3], e n é igual a 1. A lei de velocidade é portanto: velocidade = k [NO]1 [O3]1 = k [NO][O3]
No passo 3, o valor de k é determinado a partir de um conjunto de concentrações (por exemplo, os dados do ensaio 1) e da sua velocidade correspondente.
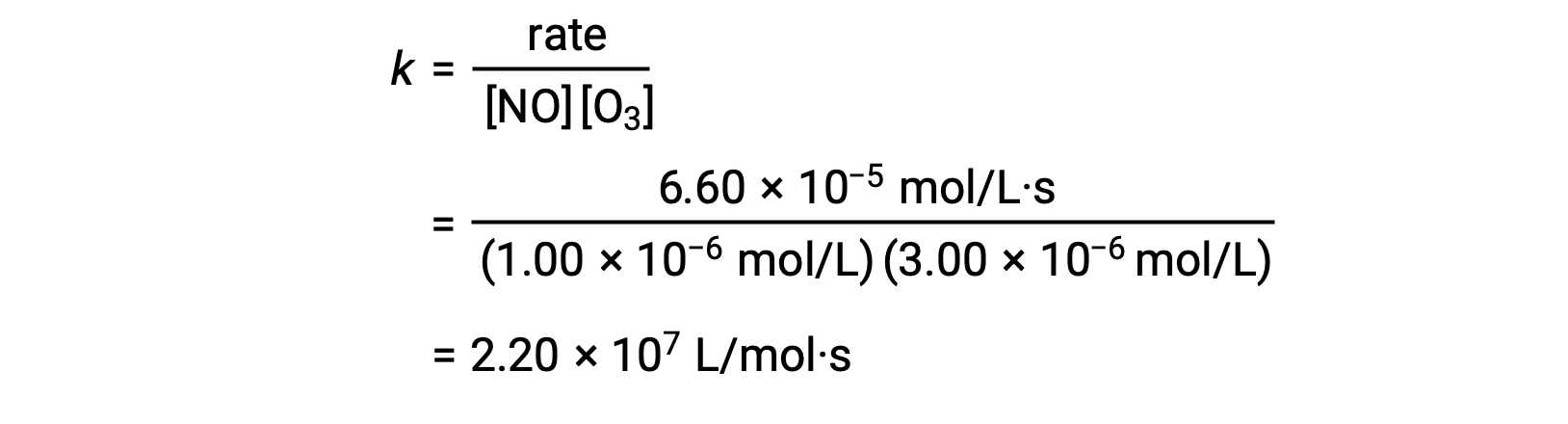
Nas reações em que os dados do método das velocidades iniciais não impliquem diretamente a relação entre as concentrações iniciais e as velocidades iniciais, pode ser utilizado um cálculo que envolve a relação das leis de velocidade para calcular a ordem de reação e a constante de velocidade.
Por exemplo, a lei de velocidade geral para a reação 2 NO (g) + Cl2 (g) ⟶ 2 NOCl (g) é expressa como: velocidade = k [NO]m [Cl2]n
Os dados do método das velocidades iniciais são:
| Teste | [NO] (mol/L) | [Cl2] (mol/L) | Velocidade Inicial (mol/L·s) |
| 1 | 0,10 | 0,10 | 0,00300 |
| 2 | 0,10 | 0,15 | 0,00450 |
| 3 | 0,15 | 0,10 | 0,00675 |
Os valores de m e n podem ser determinados a partir dos dados experimentais utilizando uma abordagem algébrica, após a qual o valor de k é determinado.
No passo 1, o valor de m é determinado a partir dos dados onde [NO] varia e [Cl2] é constante. Uma relação de leis de velocidade é expressa substituindo os dados de dois testes diferentes (por exemplo, o teste 3 e o teste 1).
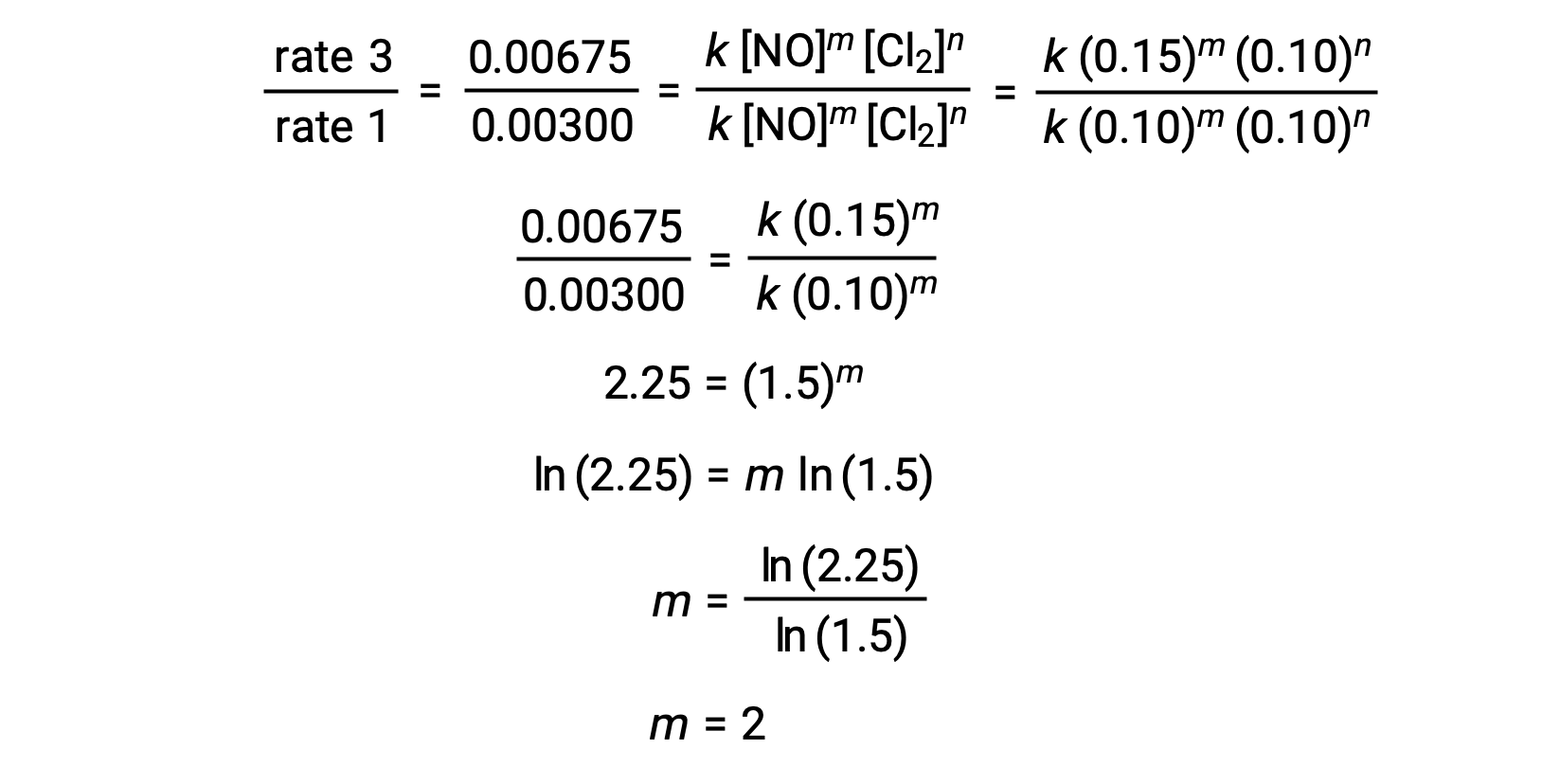
No passo 2, o valor de n é determinado a partir dos dados onde [Cl2] varia e [NO] é constante.
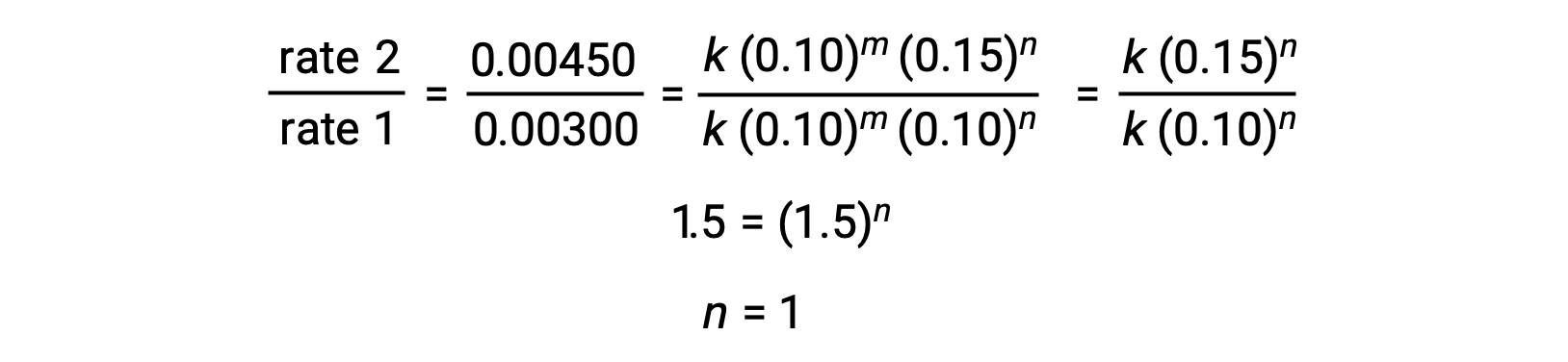
Usando os valores calculados de m e n a lei de velocidade é expressa como velocidade = k [NO]2 [Cl2].
No passo 3, o valor numérico da constante de velocidade k é determinado com unidades apropriadas. As unidades para a velocidade de uma reação são mol/L·s. As unidades para k são concluídas substituindo as unidades de todos os outros parâmetros na lei de velocidade. Neste exemplo, as unidades de concentração são mol3/L3. As unidades para k devem ser L2/mol2·s de modo a que a velocidade esteja em mol/L·s. O valor de k é determinado assim que a expressão da lei de velocidade tiver sido resolvida, simplesmente substituindo os valores de qualquer um dos testes experimentais (por exemplo, teste 1).
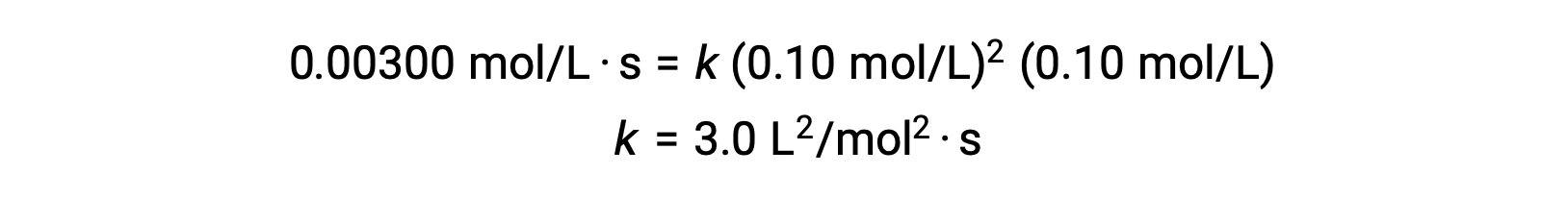
Unidades de Ordem de Reação e Constante de Velocidade
Em algumas reações, as ordens de reação na lei da velocidade são as mesmas que os coeficientes na equação química para a reação. Isto é apenas uma coincidência e muitas vezes não é o caso. As leis de velocidade podem apresentar ordens fracionárias para alguns reagentes, e ordens de reação negativas são às vezes observadas quando um aumento na concentração de um reagente causa uma diminuição na velocidade de reação. As leis de velocidade são determinadas apenas por experiências e não são previstas de forma confiável pela estequiometria da reação.
As unidades para uma constante de velocidade irão variar conforme apropriado para acomodar a ordem geral da reação. A unidade da constante de velocidade para uma reação de ordem zero é mol/L·s (ou M/s) e para uma reação de primeira ordem é 1/s. A unidade da constante de velocidade para uma reação de segunda ordem é L/mol·s (ou 1/M·s) e para uma reação de terceira ordem é L2/mol2·s. Embora as unidades específicas de concentração e tempo sejam indicadas como (mol/L) e (s), podem ser utilizadas quaisquer outras unidades válidas para representar as propriedades de concentração e tempo.
Este texto é adaptado de Openstax, Chemistry 2e, Section 12.3: Rate Laws.
