13.4:
确定反应顺序
13.4:
确定反应顺序
速率定律描述了化学反应速率与其反应物的浓度之间的关系。 在速率定律中,通过观察反应物浓度变化时的反应速度变化,实验确定了变化率常数 k 和反应顺序。 确定速率定律的一个常见实验方法是初始速率方法。 这种方法包括测量使用不同初始反应物浓度进行的多项实验试验的反应率。 通过比较这些试验的测量速率,可以确定反应命令,以及随后的速率常数,这些常量一起被用于制定速率定律。
例如,一种反应的速率,涉及臭氧中的一氧化氮 [NO (g) + O3 (g) ⟶ NO2 (g) + O2 (g)] 可以根据 实验室初始速率方法的实验数据来确定。
| 试用 | [NO] (mol/L) | [O3] (mol/L) | Δ[NO2]/Δt (mol/L·s) |
| 1 | 1.00 × 10−6 | 3.00 × 10−6 | 6.60 × 10−5 |
| 2 | 1.00 × 10−6 | 6.00 × 10−6 | 1.32 × 10−4 |
| 3 | 1.00 × 10−6 | 9.00 × 10−6 | 1.98 × 10−4 |
| 4 | 2.00 × 10−6 | 9.00 × 10−6 | 3.96 × 10−4 |
| 5 | 3.00 × 10−6 | 9.00 × 10−6 | 5.94 × 10−4 |
根据速率数据,形成了一个通用的速率定律;速率 = k[NO]m[O3]n。 反应顺序m 和 n的值以及速率常数k 由实验数据通过三部分过程确定:
在步骤 1 中,m的值由 [NO] 变化的数据确定,而 [O3] 是恒定的。 在第 3 、第 4 和第 5 项审判中,[NO] 各不相同,而 [O3] 保持不变。 如果在第 3 轮至第 4 轮中 [NO] 翻一番,则率值翻一番;在第 3 轮至第 5 轮中[NO] 翻三番时,率值也翻三番。 因此,率值也直接成正比[NO],速率定律中的 m 等于 1。
在步骤 2 中,n的值由 [O3] 变化且 [NO] 不变的数据决定。 在试验 1、2 和 3 中,[NO]是恒定的,[O3] 是不同的。 反应速度与 [O3] 的变化成正比。 当 [O3] 在第 1 轮至第 2 轮中翻了一番时,利率会翻了一番;当 [O3] 在第 1 轮至第 3 轮中翻了一番时,率值也会增加三倍。 因此,该比率与 [O3] 直接成比例,n 等于 1。 因此,速率定律为: 速率 = k [NO]1 [O3]1 = k [NO][O3]
在步骤 3 中,k 的值由一组浓度 (例如,试验 1 中的数据) 及其相应的比率决定。
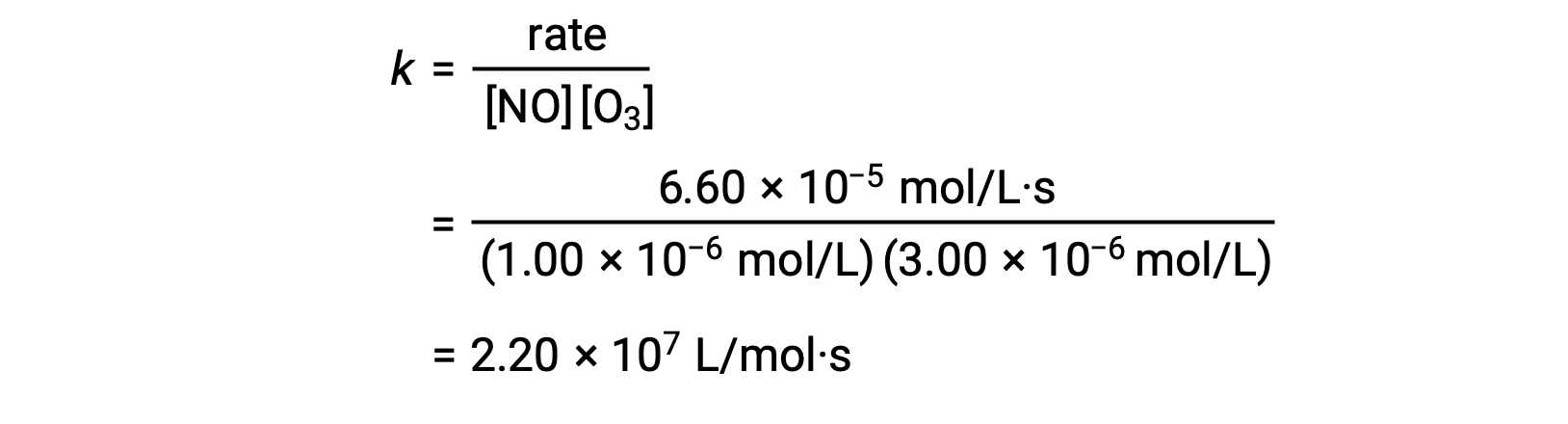
如果初始施量方法中的数据不直接暗示初始浓度和初始施量之间的关系,则可以使用速率定律比率计算反应顺序和施量常数。
例如,反应 2 NO (g) + Cl2 (g) ⟶ 2 NOCl (g) 的常规速率定律表示为: 速率= k [NO]m [Cl2]n。
初始速率方法的数据如下:
| 试用 | [NO] (mol/L) | [Cl2] (mol/L) | 初始率 (mol/L·s) |
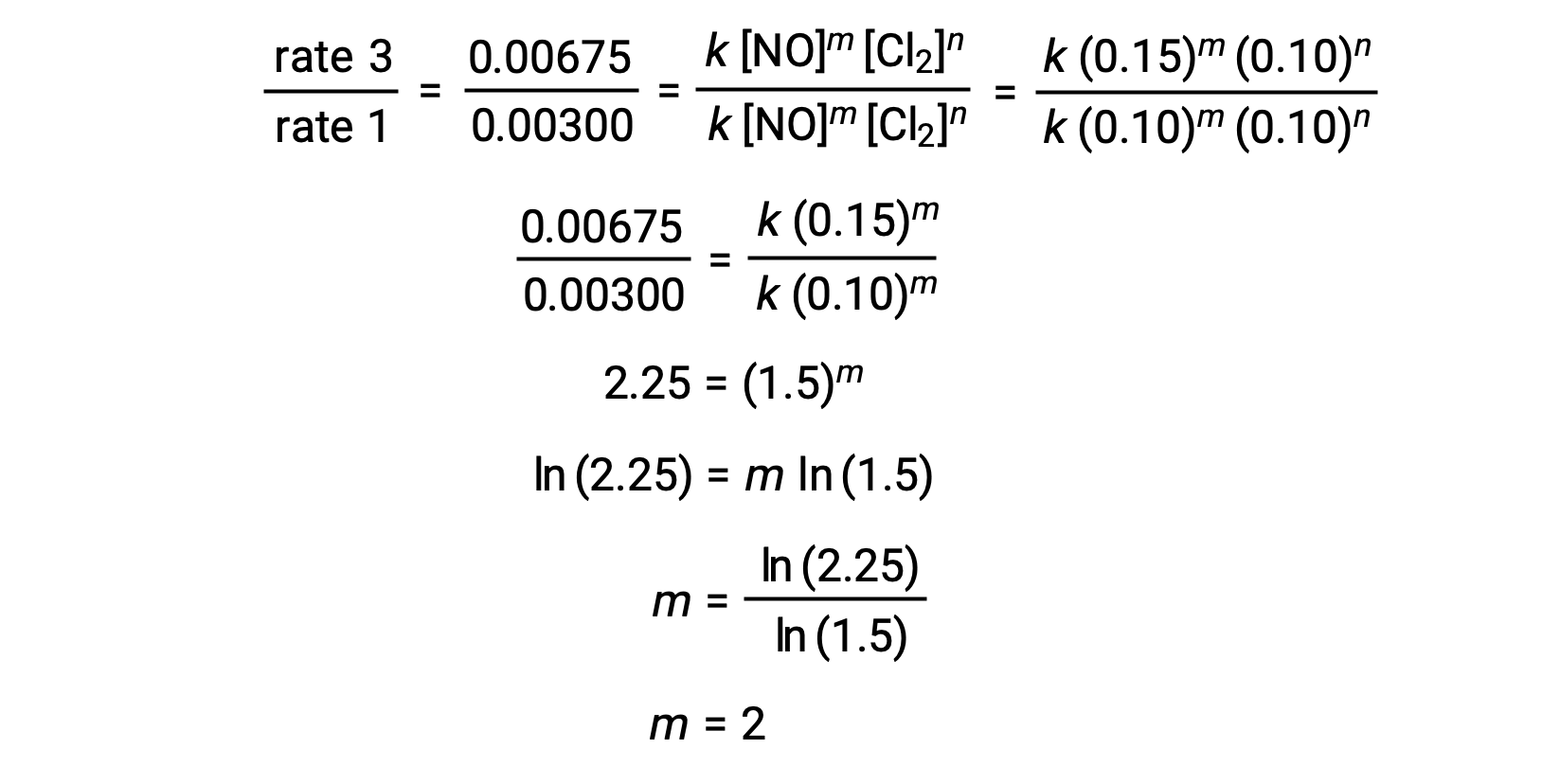
| 1 | 0.10 | 0.10 | 0.00300 |
| 2 | 0.10 | 0.15 | 0.00450 |
| 3 | 0.15 | 0.10 | 0.00675 |
m 和n的值可以使用代数法从实验数据中确定,然后 k 确定的值。
在步骤 1 中, m 的值由 [NO] 变化且 [Cl2] 恒定的数据决定。 速率定律的比率用两个不同试验 (例如试验 3 和试验 1) 的数据来表示。
在步骤 2 中,n的值由[Cl2]变化的数据确定, [NO] 是恒定的。
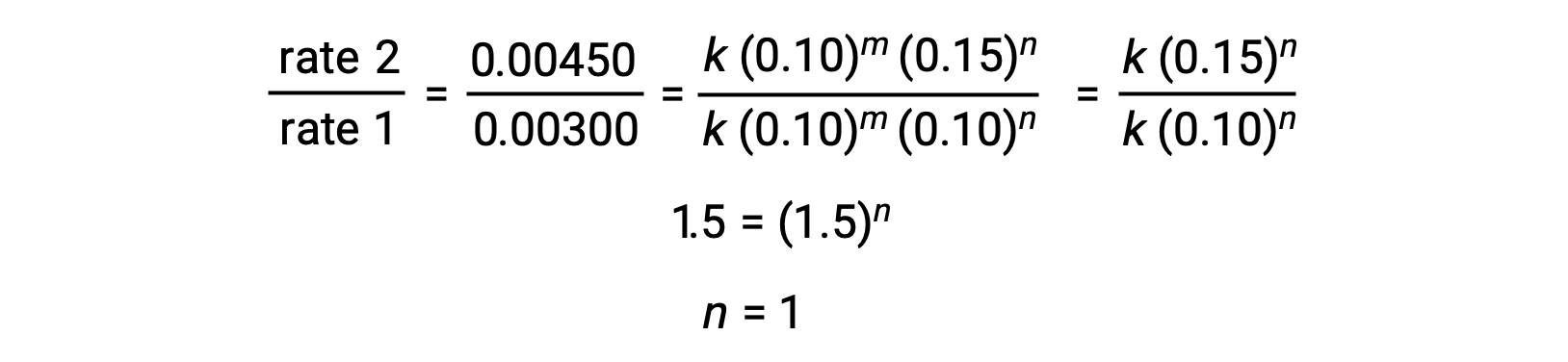
使用m 和n的计算值,速率定律表示为速率 = k [NO]2 [Cl2]。
在步骤 3 中,速率常数k的数值由适当的单位确定。 反应速率单位为 mol/L·s 以速率定律中所有其他参数的单位替换 k 的单位。 在本例中,浓度单位为 mol3/L3。 k的单位应该是 L2/mol2·s,这样速率就以 mol/L·s 为单位 k的值是在速率定律表达式解算后确定的,方法是简单地替换任何试验试验试验 (例如试验 1) 中的值。
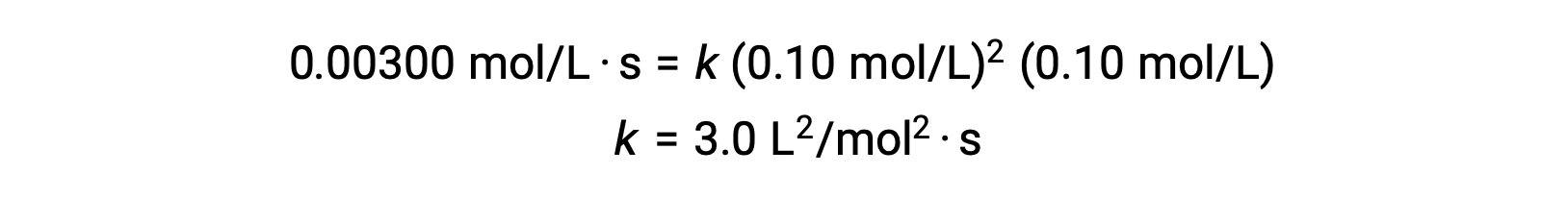
反应顺序和率值恒定单位
在某些反应中,速率定律中的反应顺序恰好与化学方程中的反应系数相同。 这只是巧合,但情况往往并非如此。 速率定律对于某些反应物可能表现出分数阶,并且当一种反应物的浓度升高导致反应速率降低时,有时会观察到负反应阶数。速率定律只能通过实验确定,而不能通过反应化学计量法可靠地预测。
率值常数的单位将根据反应的整体顺序而有所不同。 零阶反应的率值常数单位是 mol/L·s (或 M/s) ,而对于一阶反应的单位是 1/s 二阶反应的率值常数单位是 L/mol·s (或 1/M·s) ,第三阶反应的单位是L2/mol2·s尽管浓度和时间的特定单位表示为 (mol/L) 和 (s) ,但任何其他有效单位都可用于表示浓度和时间的性质。
