13.4:
반응차수 계산
13.4:
반응차수 계산
속도 법은 화학 반응의 속도와 반응의 농도 사이의 관계를 설명합니다. 속도법에서, 반응체의 농도가 변화함에 따라 반응 속도가 어떻게 변하는지 관찰함으로써 속도 상수 k 및 반응 순서가 실험적으로 결정된다. 금리법 결정에 대한 일반적인 실험적 접근 방식은 초기 금리의 방법입니다. 이 방법은 다른 초기 반응성 농도를 사용하여 수행 된 다중 실험 시험에 대한 반응 속도를 측정하는 것을 포함한다. 이러한 시험에 대한 측정 된 비율을 비교하면 반응 명령의 결정이 허용되며, 그 후 속도상수는 비율 법을 공식화하는 데 사용됩니다.
반응의 속도는, 예를 들어, 오존을 포함하는 산화질소[NO(NO)+ O3 (g)NO2 (g) + O2 (g)]를포함하는 반응의 비율은 실험실에서 초기 속도의 방법의 실험 데이터로부터 결정될 수 있다.
| 평가판 | 【아니오】 (몰/L) | [O3] (몰/L) | Δ[NO2]/Δ t(몰/L/s) |
| 1 | 1.00 × 10-6 | 3.00 × 10-6 | 6.60 × 10-5 |
| 2 | 1.00 × 10-6 | 6.00 × 10-6 | 1.32 × 10-4 |
| 3 | 1.00 × 10-6 | 9.00 × 10-6 | 1.98 × 10-4 |
| 4 | 2.00 × 10-6 | 9.00 × 10-6 | 3.96 × 10-4 |
| 5 | 3.00 × 10-6 | 9.00 × 10-6 | 5.94 × 10-4 |
금리 데이터에서 일반 요율법; 속도 = k[NO]m[O3]n이 공식화됩니다. 반응 주문 m 및 n의값및 속도 상수 k는 3부 과정을 사용하여 실험 데이터로부터 결정됩니다.
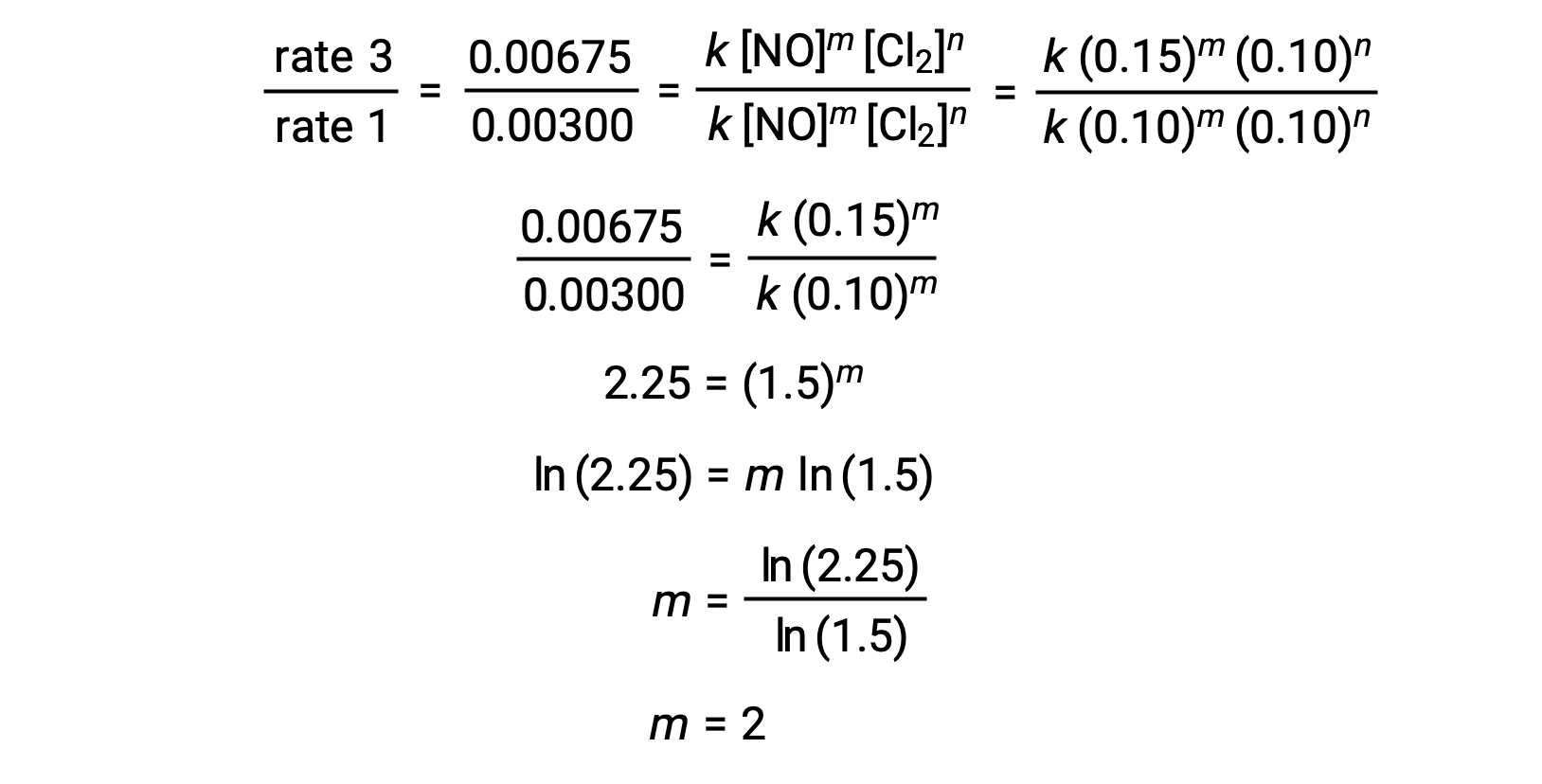
1단계에서m값은 [NO]가 변하는 데이터로부터 결정되고 [O3]이일정하다. 시험 3, 4 및 5에서는 [No]가 다르지만 [O3]은일정하게 유지됩니다. [NO]가 시험 3에서 4로 두 배가 되면 속도가 두 배로 증가했으며 [NO]가 시험 3에서 5로 세 배가 되면 속도도 세 배가 됩니다. 따라서, 비율은 [NO]에 직접 비례하며, m는 속도법에서 1과 같다.
2단계에서n값은 [O3]가다르고 [NO]가 일정한 데이터로부터 결정된다. 시험 1,2, 3에서는 [NO]가 일정하고 [O3]이다릅니다. 반응 속도는 [O3]의변화에 직접 비례하여 변경됩니다. [O3]가시험 1에서 2로 두 배가 되면, 비율은 두 배로; [O3]가시험 1에서 3으로 세 배가 되면 속도도 세 배로 증가합니다. 따라서, 속도는 [O3]에정비례하며, n은 1과 같다. 따라서 속도 법은 : 속도 = k [NO]1 [O3]1 = k [NO][O3]】
3단계에서 k값은 한 세트의 농도(예: 예: 평가판 1의 데이터)와 해당 속도에서 결정됩니다.
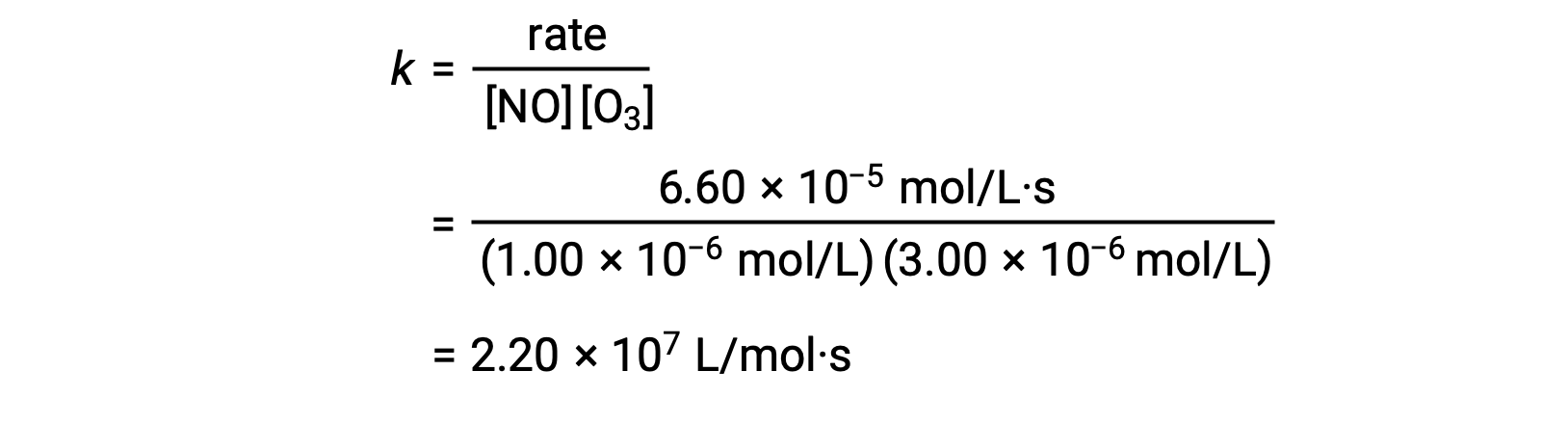
초기 금리 방법의 데이터가 초기 농도와 초기 비율 사이의 관계를 직접적으로 의미하지 않는 반응에서, 비율법의 비율을 포함하는 계산을 사용하여 반응 순서와 일정한 비율을 계산할 수 있습니다.
예를 들어, 반응 2 NO(g)+ Cl2 (g) ∞ 2 NOCl(g)에대한 일반 요율 법은 : 속도 = k [NO]m[Cl2]n로표현된다.
초기 요금 방법의 데이터는 다음과 같습니다.
| 평가판 | 【아니오】 (몰/L) | [Cl2] (몰/L) | 초기 요금(mol/L·s) |
| 1 | 0.10 | 0.10 | 0.00300 |
| 2 | 0.10 | 0.15 | 0.00450 |
| 3 | 0.15 | 0.10 | 0.00675 |
m 및 n의 값은 k의 값이 결정되는 대수 접근법을 사용하여 실험 데이터에서 결정될 수 있다.
1단계에서m값은 [NO]가 변하고 [Cl2]가일정한 데이터로부터 결정된다. 비율 법의 비율은 두 개의 서로 다른 시험 (예 : 재판 3 및 재판 1)의 데이터를 대체하여 표현됩니다.
2단계에서n값은 [Cl2]가다르고 [NO]가 일정한 데이터로부터 결정됩니다.

m 및 n의 계산값을 사용하여 속도 법칙은 속도 = k [NO]2 [Cl2]로표현됩니다.
3단계에서, 속도 상수 k의 수치값은 적절한 단위로 결정된다. 반응 속도에 대한 단위는 mol / L/s입니다. K의 단위는 속도 법에서 다른 모든 매개 변수의 단위를 대체하여 결론을 내린다. 이 예에서, 농도 단위는 몰3/L3이다. K의 단위는 L2/mol2·s여야 하므로 속도가 mol/L/s의 관점에서 볼 수 있습니다. k의 값은 단순히 실험 시험 (예 : 재판 1)에서 값을 대체하여, 속도 법 표현이 해결되면 결정됩니다.

반응 순서 및 속도 상수 단위
일부 반응에서, 속도 법의 반응 명령은 반응에 대한 화학 방정식의 계수와 동일하게 된다. 이것은 단지 우연의 일치이며 종종 그렇지 않습니다. 요금법은 일부 반응제에 대해 분수 명령을 나타낼 수 있으며, 반응율이 증가할 경우 부정적인 반응 순서가 관찰되기도 한다. 속도 법은 실험에 의해서만 결정되며 반응 stoichiometry에 의해 안정적으로 예측되지 않습니다.
속도 상수 단위는 반응의 전체 순서를 수용하기 위해 적절하게 달라집니다. 제로 오더 반응에 대한 속도 상수의 단위는 mol /L/s (또는 M/s)이며 1 차 반응의 경우 1 /s입니다. 2차 반응에 대한 속도 상수의 단위는 L/mol·s(또는 1/M·/s)이며, 3차 반응의 경우L2/mol2·s이다. 농도 및 시간에 대한 특정 단위는 (mol/L) 및 (들)로 표시되지만, 다른 유효한 단위는 농도 및 시간의 특성을 나타내는 데 사용할 수 있습니다.
