13.12:
Enzymes
13.12:
Enzymes
À l’intérieur des organismes vivants, les enzymes agissent comme des catalyseurs pour de nombreuses réactions biochimiques impliquées dans le métabolisme cellulaire. Le rôle des enzymes est de réduire les énergies d’activation des réactions biochimiques en formant des complexes avec ses substrats. La diminution des énergies d’activation favorise une élévation des vitesses de réactions biochimiques.
Les carences enzymatiques peuvent souvent se traduire par des maladies potentiellement mortelles. Par exemple, une anomalie génétique entraînant une déficience de l’enzyme G6PD (glucose-6-phosphate déshydrogénase) impacte négativement la voie métabolique alimentant les cellules en NADPH.
Une perturbation de cette voie métabolique peut réduire le glutathion dans les globules rouges causant des dommages à d’autres enzymes et protéines comme l’hémoglobine. La métabolisation excessive de l’hémoglobine augmente le taux de bilirubine, ce qui entraîne une jaunisse, un état de santé qui peut devenir grave. Par conséquent, les personnes qui souffrent d’un déficit en G6PD doivent éviter certains aliments et médicaments contenant des produits chimiques qui pourraient déclencher des dommages à leurs globules rouges déficients en glutathion.
Fonction et structure des enzymes
Les enzymes sont regroupées en différentes classes basées sur la fonction spécifique qu’elles exécutent. Par exemple, les oxydoréductases sont impliquées dans les réactions redox, tandis que les transférases catalysent le transfert de groupes fonctionnels. La formation de liaisons avec l’hydrolyse de l’ATP nécessite des ligases, alors que les réactions d’hydrolyse et la formation de doubles liaisons sont respectivement catalysées par les hydrolases et les lyases. Les enzymes isomérases catalysent généralement les réactions d’isomérisation.
Les enzymes possèdent généralement des sites actifs. Il s’agit de régions précises de la molécule avec une conformation qui favorise la fixation de l’enzyme à un substrat spécifique (une molécule de réactif) pour former un complexe enzyme-substrat ou l’intermédiaire de la réaction.
Deux modèles, le modèle clé-serrure et l’ajustement induit, tentent d’expliquer le fonctionnement d’un site actif (figure 1). L’hypothèse clé-serrure la plus simpliste suggère que le site actif et la forme moléculaire du substrat sont complémentaires, s’ajustant ensemble comme une clé dans une serrure (figure 1a). D’autre part, l’hypothèse de l’ajustement induit suggère que l’enzyme est une molécule souple et qu’elle change de forme pour adapter une liaison avec le substrat (figure 1b).
Cependant, le modèle clé-serrure et le modèle d’ajustement induit tiennent compte du fait que les enzymes ne peuvent se lier qu’à des substrats spécifiques et ne catalysent qu’une réaction particulière.
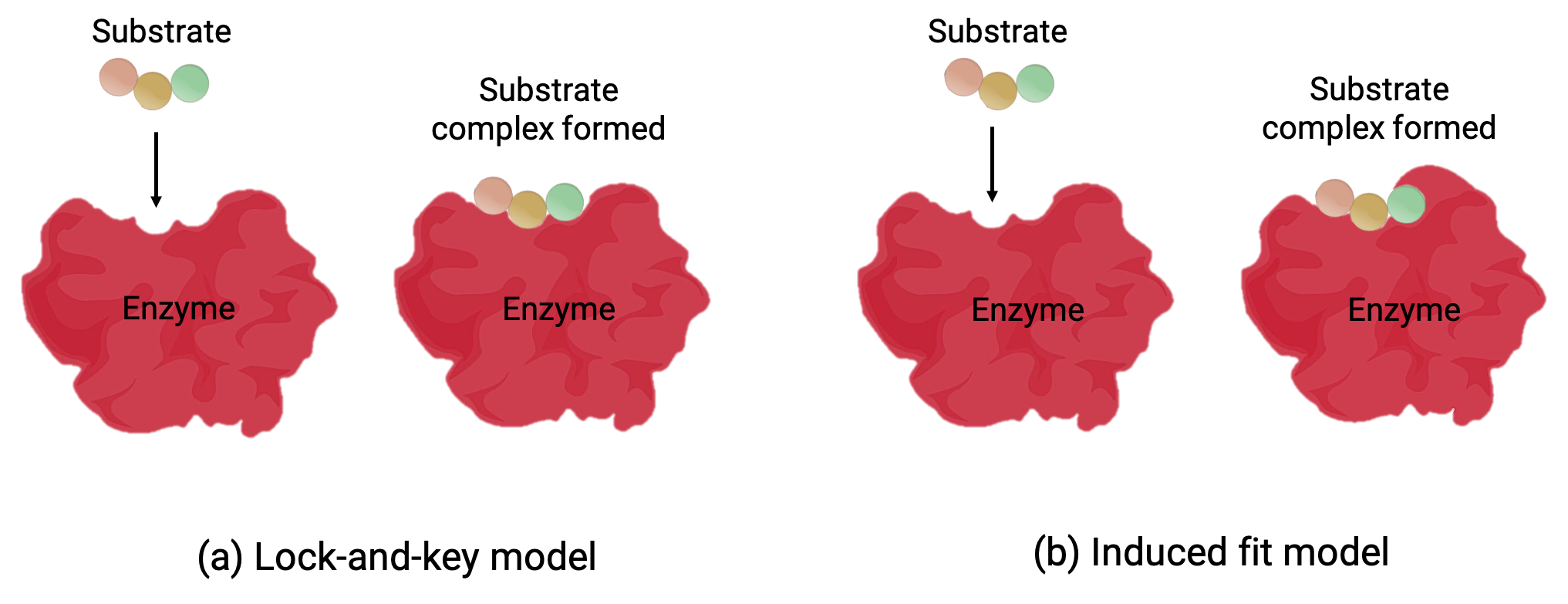
Figure 1 (a) Selon le modèle clé-serrure, la forme du site actif d’une enzyme est parfaitement ajustée au substrat. (b) Selon le modèle d’ajustement induit, le site actif est quelque peu flexible et peut changer de forme afin de se lier au substrat.
Inhibiteurs enzymatiques
L’activité des enzymes peut également être interrompue par le processus d’inhibition enzymatique. Il existe plusieurs types communs d’inhibition enzymatique.
Pendant l’inhibition compétitive, une molécule (naturelle ou synthétique) autre que le substrat se lie directement au site actif de l’enzyme. La similarité structurale et chimique entre l’inhibiteur et le substrat facilite sa fixation au site actif. De tels inhibiteurs compétitifs sont, donc, en concurrence avec les substrats, les empêchant de se lier à l’enzyme. Le plus souvent, l’augmentation de la concentration du substrat peut supprimer les effets de l’inhibition compétitive.
En cas d’inhibition non compétitive, une molécule (naturelle ou synthétique) se lie à une région allostérique (autre) de l’enzyme, différente de son site actif. La fixation de l’inhibiteur entraîne un changement conformationnel du site actif de l’enzyme, ce qui entraîne une diminution de la capacité de l’enzyme à catalyser la réaction. Contrairement à l’inhibition compétitive, une augmentation de la concentration du substrat n’atténue pas les effets inhibiteurs de l’inhibition non compétitive.
Une partie de ce texte est adaptée de Openstax, Chimie 2e, Section 12.7 : Catalyse.
