13.12:
酵素
13.12:
酵素
生体内において、酵素は細胞代謝に関与する多くの生化学反応の触媒として機能します。酵素の役割は、その基質と複合体を形成することにより、生化学反応の活性化エネルギーを低下させることです。活性化エネルギーの低下は、生化学反応の速度を増加させます。
酵素が欠乏すると、生命を脅かす病気につながることがよくあります。例えば、酵素G6PD(グルコース-6-リン酸デヒドロゲナーゼ)の欠損をもたらす遺伝的異常は、NADPHを細胞に供給する代謝経路に悪影響を及ぼす。
この代謝経路の崩壊は、赤血球中のグルタチオンを減少させ、ヘモグロビンのような他の酵素やタンパク質に損傷を与える可能性があります。ヘモグロビンの過剰な代謝はビリルビンレベルを高め、黄疸を引き起こす。したがって、G6PD欠損症に苦しむ人々は、グルタチオン欠損赤血球に損傷を与える可能性のある化学物質を含む特定の食品や医薬品を避ける必要があります。
酵素の機能と構造
酵素は、その特定の機能に基づいて、さまざまな種類に分類されます。例えば、オキシドレダクターゼは酸化還元反応に関与し、トランスフェラーゼは官能基の転移を触媒します。 ATP加水分解による結合形成にはリガーゼが必要ですが、加水分解反応と二重結合形成は、それぞれ加水分解酵素とリアーゼによって触媒されます。イソメラーゼ酵素は通常、異性化反応を触媒します。
酵素は一般的に活性部位を持ちます。これらは、酵素が特定の基質(反応物分子)に結合して酵素-基質複合体または反応中間体を形成するのに有利な配置となるような、分子上の特定の領域です。
2つのモデル—鍵と鍵穴モデルと誘導適合モデル—は、活性部位の働きを説明する(Figure 1)。最も単純な鍵と鍵穴モデルは、活性部位と基質の分子形状が相補的であり、鍵穴と鍵のように組み合わさることを示す(Figure 1a)。一方、誘導適合モデルは、酵素分子が柔軟で、基質との結合に対応するために形状が変化することを示します。(Figure 1b)
ただし、鍵と鍵穴モデルと誘導適合モデルはどちらも、酵素が特定の基質とのみ結合でき、特定の反応のみを触媒するという事実を示しています。
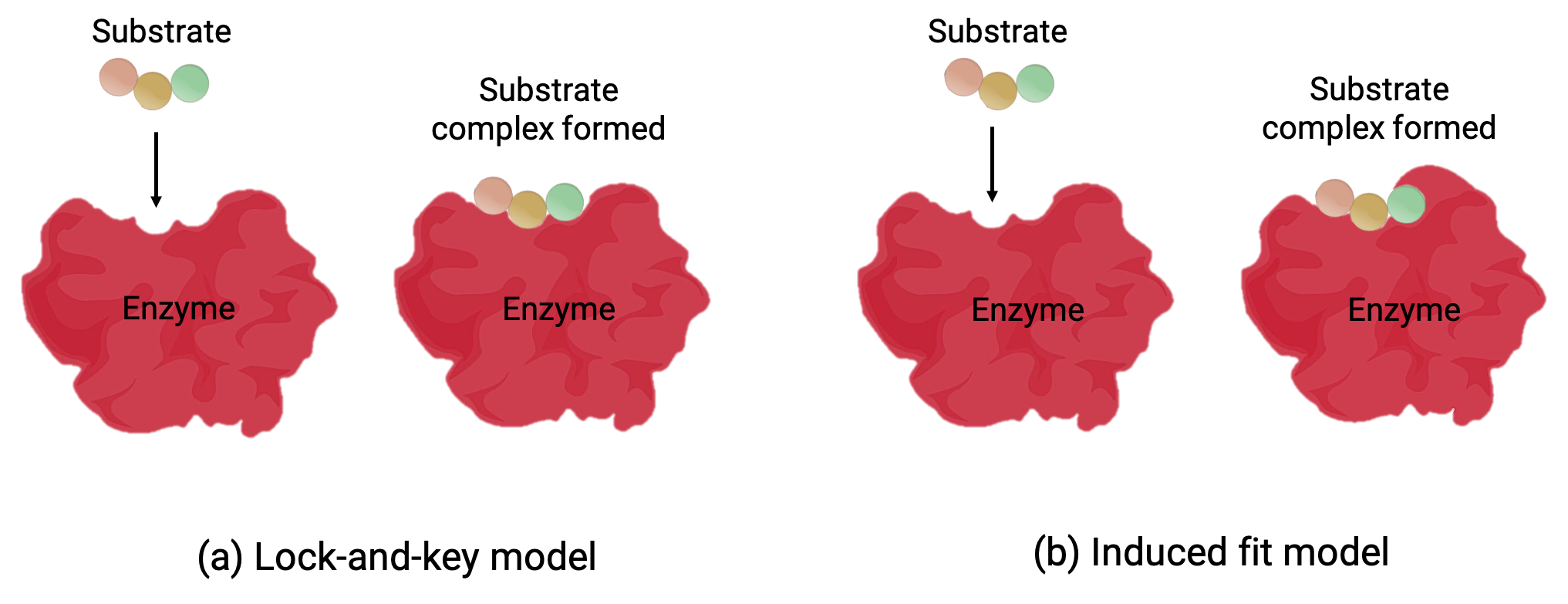
Figure 1 (a)鍵と鍵穴モデルによると、酵素の活性部位の形状は基質に完全に適合します。 (b)誘導適合モデルによると、活性部位は柔軟性があり、基板と結合するために形状を変えることができます。
酵素阻害剤
酵素の活性は、酵素阻害のプロセスによって中断される可能性があります。酵素阻害にはいくつかの種類があります。
競合阻害プロセスでは、基質以外の分子が酵素の活性部位に直接結合します。阻害剤の基質に対する構造的および化学的類似性は、活性部位への結合を促進します。したがって、そのような競合阻害剤は基質と競合し、それらが酵素に結合するのを妨げます。ほとんどの場合、基質濃度を上げると、競合阻害の影響を抑えることができます。
非競合的阻害では、分子は、その活性部位とは異なり、酵素のアロステリック(その他)領域に結合します。阻害剤の結合は、酵素の活性部位の配座変化を引き起こし、結果として反応を触媒する酵素の作用が低下します。競合阻害とは異なり、基質濃度の増加は非競合阻害の阻害効果を軽減しません。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Section 12.7: Catalysis.
