15.9:
Misturas de Ácidos
15.9:
Misturas de Ácidos
O pH de uma solução contendo um ácido pode ser determinado utilizando a sua constante de dissociação do ácido e a sua concentração inicial. Se uma solução contiver dois ácidos diferentes, então o seu pH pode ser determinado usando um de vários métodos dependendo da força relativa dos ácidos e das suas constantes de dissociação.
Uma Mistura de um Ácido Forte e um Ácido Fraco
Em uma mistura de um ácido forte e um ácido fraco, o ácido forte dissocia-se completamente e torna-se uma fonte de quase todos os iões hidrónio presentes na solução. Em contraste, o ácido fraco apresenta dissociação parcial e produz uma concentração insignificante de iões hidrónio. A alta concentração de iões hidrónio produzidos pelo ácido forte reduz ainda mais a dissociação do ácido fraco. Isto acontece porque, de acordo com o princípio de Le Chatelier – “Quando um sistema químico em equilíbrio é perturbado, o sistema desloca-se em uma direção que minimize as perturbações.” O excesso de iões hidrónio produzido pelo ácido forte perturba o equilíbrio, e assim a reação irá mover-se na direção inversa até que o equilíbrio seja estabelecido. Isto leva a uma diminuição na dissociação do ácido fraco. Por causa desta diminuição, um pH de uma mistura de um ácido forte e um fraco pode ser apenas calculado a partir da concentração do ácido forte. Por exemplo, o pH de uma mistura com uma concentração igual de ácido clorídrico (HCl), um ácido forte, e ácido fórmico (HCHO2), um ácido fraco, só pode ser determinado a partir da concentração de HCl. Se a concentração de HCl na mistura for de 0,0020 M, o seu pH pode ser calculado da seguinte forma:
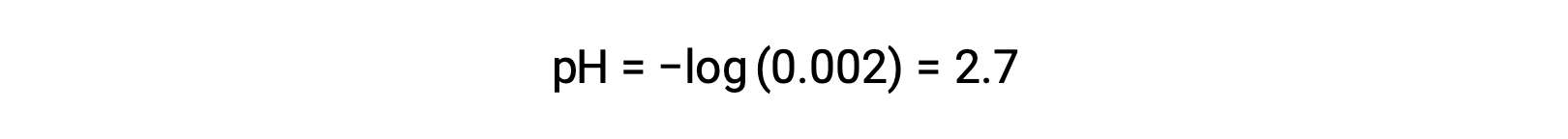
Aqui, a concentração de iões hidrónio produzidos pelo HCHO2 e a autoionização da água é insignificante e, portanto, pode ser ignorada.
Uma Mistura de dois Ácidos Fracos com Constantes de Dissociação Diferentes
Em uma mistura de dois ácidos fracos, o pH de uma mistura será determinado pelo ácido mais forte se a sua constante de dissociação for significativamente mais elevada do que o ácido mais fraco. Por exemplo, em uma mistura com igual concentração de ácido nitroso (HNO2) e ácido hipocloroso (HClO), o HNO2 será o principal determinante do pH da mistura uma vez que a sua Ka (4,6 × 10−4) é aproximadamente 10.000 vezes maior que a Ka (2,9 × 10−8) do HClO. De acordo com o princípio de Le Chatelier, o HClO mostra uma dissociação reduzida na presença de HNO2.
