15.9:
Mezclas de Ácidos
15.9:
Mezclas de Ácidos
El pH de una solución que contiene un ácido puede determinarse utilizando su constante de disociación ácida y su concentración inicial. Si una solución contiene dos ácidos diferentes, entonces su pH puede determinarse usando uno de varios métodos dependiendo de la fuerza relativa de los ácidos y sus constantes de disociación.
Una mezcla de un ácido fuerte y un ácido débil
En una mezcla de un ácido fuerte y un ácido débil, el ácido fuerte se disocia completamente y se convierte en la fuente de casi todos los iones hidronio presentes en la solución. En contraste, el ácido débil muestra disociación parcial y produce una concentración insignificante de iones hidronio. La alta concentración de iones hidronio producida por el ácido fuerte reduce aún más la disociación del ácido débil. Esto sucede porque, según el principio de Le Chatelier, “cuando se altera un sistema químico en equilibrio, el sistema cambia en una dirección que minimiza la perturbación.”El exceso de iones hidronio producido por el ácido fuerte perturba el equilibrio, y por lo tanto la reacción procederá en la dirección inversa hasta que se establezca el equilibrio. Esto conduce a una disminución en la disociación del ácido débil. Debido a esta disminución, un pH de una mezcla de un ácido fuerte y uno débil puede ser calculado solamente a partir de la concentración del ácido fuerte. Por ejemplo, el pH de una mezcla con una concentración igual de ácido clorhídrico (HCl), un ácido fuerte, y ácido fórmico (HCHO2), un ácido débil, sólo puede determinarse a partir de la concentración de HCl. Si la concentración del HCl en la mezcla es de 0,0020 M, su pH puede calcularse de la siguiente manera.
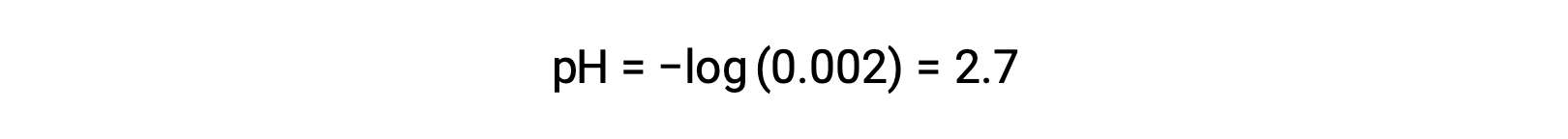
Aquí, la concentración de iones hidronio producida por el HCHO2 y la autoionización del agua es insignificante y por lo tanto puede ser ignorada.
Mezcla de dos ácidos débiles con diferentes constantes de disociación
En una mezcla de dos ácidos débiles, el pH de una mezcla será determinado por el ácido más fuerte si su constante de disociación es significativamente mayor que el ácido más débil. Por ejemplo, en una mezcla con una concentración igual de ácido nitroso (HNO2) y ácido hipocloroso (HClO), el HNO2 será el principal determinante del pH de la mezcla, ya que su Ka (4,6 × 10−4) es aproximadamente 10.000 veces mayor que el Ka (2,9 × 10−8) de HClO. Según el principio de Le Chatelier, HClO muestra una disociación reducida en presencia de HNO2.
