15.9: 酸的混合物
含有酸的溶液的 pH 值可以使用酸解离常数和初始浓度来确定。 如果溶液含有两种不同的酸,则可以使用多种方法之一来确定其 pH 值,具体取决于酸的相对强度及其解离常数。
强酸和弱酸的混合
在强酸和弱酸的混合中,强酸完全分离,并成为溶液中几乎所有水合氢离子的来源。 相比之下,弱酸显示部分离解并产生可忽略的水合氢离子浓度。 强酸生产的高水合氢离子浓度进一步降低了弱酸的离解。 这是因为,根据 勒夏特列原理(Le Chatelier's Principle) ——“当平衡的化学系统受到干扰时,系统会朝着最大程度减少干扰的方向移动。 ” 强酸产生的过量水合氢离子干扰了平衡,因此,反应将反向移动,直到平衡得到确定。 这会导致弱酸的离解降低。 由于这一下降,强和弱酸混合物的 pH 值只能从强酸的浓度中计算。 例如,具有同等浓度的氢氯酸 (HCl) ,强酸和弱酸的甲酸 (HCHO2) 的混合物的 pH 值只能从浓度的氢氯酸确定。 如果混合物中 HCl 的浓度为 0.0020 M ,则其 pH 值可按以下公式计算。
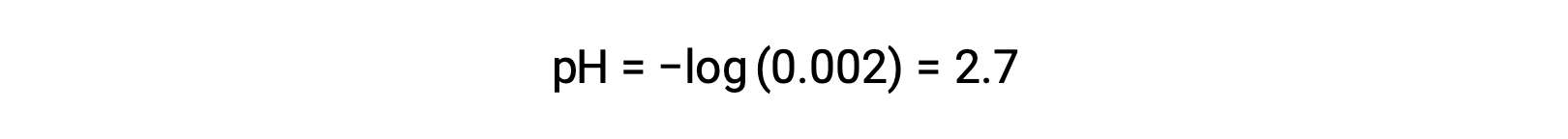
在这里,由 HCA2 和水的自电离生产的水合氢离子浓度可以忽略不计,因此可以忽略。
两个弱酸与不同解离常数的混合
在两种弱酸混合物中,如果混合物的解离常数明显高于弱酸,混合物的 pH 值将由强酸确定。 例如,如果混合物中的氮酸 (HNO2) 和次氯酸 (HCLO) 的浓度相等,则 HNO2 将是混合物 pH 的主要决定因素,因为其 Ka (4.6 × 10−4) 大约比 HCLO 的 Ka (2.9 × 10−8) 高 10,000 倍。 根据勒查特勒的原则, HCLO 在 HNO2的存在下显示离解下降。


