15.9:
산 혼합
15.9:
산 혼합
산을 함유하는 용액의 pH는 산 성 해리상수 및 초기 농도를 사용하여 결정될 수 있다. 용액에 두 가지 다른 산이 포함되어 있는 경우, 그 pH는 산의 상대강도와 해리 상수에 따라 여러 가지 방법 중 하나를 사용하여 결정할 수 있다.
강한 산과 약한 산의 혼합물
강한 산과 약한 산의 혼합물에서, 강한 산은 완전히 해리하고 용액에 존재하는 거의 모든 하이드로늄 이온의 공급원이된다. 대조적으로, 약한 산은 부분 해리를 보여주고 하이드로늄 이온의 무시할 수 있는 농도를 생성합니다. 강한 산에 의해 생성 된 하이드로늄 이온의 높은 농도는 더 약한 산의 해리를 감소시킨다. 이는 르 샤텔리에의 원칙에 따르면 “평형의 화학 시스템이 방해를 받으면 시스템이 교란을 최소화하는 방향으로 이동한다”는 원칙에 따라 발생합니다. 강한 산에 의해 생성된 과잉 하이드로늄 이온은 평형을 방해하고, 따라서 평형이 확립될 때까지 반응이 역방향으로 이동한다. 이것은 약한 산의 해리의 감소로 이끌어 냅니다. 이러한 감소로 인해, 강하고 약한 산의 혼합물의 pH는 강한 산의 농도에서만 계산될 수 있다. 예를 들어, 염산(HCl)의 농도가 동등한 혼합물의 pH, 강한 산, 및 포산(HCHO2),약한 산은 HCl의 농도에서만 결정될 수 있다. 혼합물에서 HCl의 농도가 0.0020 M인 경우, 그 pH는 다음과 같이 계산될 수 있다.
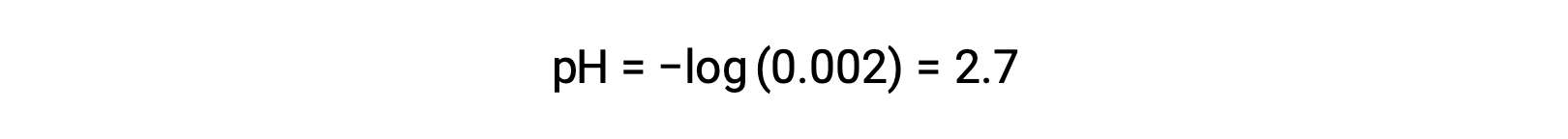
여기서, HCHO2에 의해 생성된 하이드로늄 이온의 농도와 물의 자가화는 무시할 수 있으므로 무시할 수 있다.
다른 해리 상수와 두 개의 약한 산의 혼합물
두 개의 약한 산의 혼합물에서, 혼합물의 pH는 그것의 해리 상수가 약한 산 보다 상당히 높은 경우에 강한 산에 의해 결정될 것이다. 예를 들어, 아질산(HNO2)및 저염산(HClO)의 농도가 동등한 혼합물에서 HNO2는 KA(4.6 × 10-4)가HClO의KA(2.9 × 10-8)보다 약 10,000배 높은 혼합물의 pH의 주요 결정자가 될 것이다. 르 샤텔리에의 원칙에 따르면, HClO는 HNO2의존재에 감소 된 해리를 보여줍니다.
