15.9:
酸的混合物
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Mixtures of Acids
在强酸和弱酸的混合物中,强酸完全解离并且显著 增加了水合氢离子的浓度,而弱酸仅部分解离。类似地,在两种弱酸的混合物中,相对较强的酸 比较弱的酸产生更多的水合氢离子。在这两种情况下,较弱酸的离解 在较强酸存在时受到抑制。勒沙特列原理解释为较强酸形成的 水合氢离子使平衡 向反应物转移,从而减少弱酸的离解。因此,酸的混合物的 pH 值 主要由较强酸的浓度 决定。例如,在含有 0.15M 盐酸和 0.30M 氢氰酸的混合物中,盐酸—一种强酸 产生浓度为 0.15M 的水合氢离子。相比之下,氢氰酸—一种弱酸 只能部分解离。氢氰酸产生的 水合氢离子浓度可由 氢氰酸的酸离解常数 Ka 和 ICE 表来计算。水合氢离子的初始浓度 等于盐酸的 初始浓度,0.15M,氰化物离子的初始浓度为零。水合氢离子和氰化物离子浓度的变化 用 x 表示。由于 x 是一个相对较小的数字,0.30 减去 x 可以近似为 0.30,0.15 加 x 可以使用 5%近似为 0.15。氢氰酸的 Ka 为 4.9 10⁻¹⁰,等于水合氢离子浓度 乘以氰化物离子浓度 除以氢氰酸浓度。将 ICE 表中的值代入 Ka 表达式,得出氢氰酸产生的 水合氢离子浓度,与盐酸产生的 水合氢离子浓度相比,该浓度可忽略不计。pH 值可以通过取水合氢离子浓度 的负对数来计算—0.15M。因此,混合物的 pH 值完全 由盐酸的浓度决定,即强酸。同样地,两种等量存在的弱酸混合物 的 pH 值主要由相对 较强的酸的浓度决定。例如,在氢氟酸和氢氰酸 的混合物中,氢氟酸 将是混合物 pH 值的主要决定因素,因为它的 Ka 值为 3.5×10⁻⁴,比氢氰酸的 Ka 值高出 近百万倍。
15.9:
酸的混合物
含有酸的溶液的 pH 值可以使用酸解离常数和初始浓度来确定。 如果溶液含有两种不同的酸,则可以使用多种方法之一来确定其 pH 值,具体取决于酸的相对强度及其解离常数。
强酸和弱酸的混合
在强酸和弱酸的混合中,强酸完全分离,并成为溶液中几乎所有水合氢离子的来源。 相比之下,弱酸显示部分离解并产生可忽略的水合氢离子浓度。 强酸生产的高水合氢离子浓度进一步降低了弱酸的离解。 这是因为,根据 勒夏特列原理(Le Chatelier’s Principle) ——“当平衡的化学系统受到干扰时,系统会朝着最大程度减少干扰的方向移动。 ” 强酸产生的过量水合氢离子干扰了平衡,因此,反应将反向移动,直到平衡得到确定。 这会导致弱酸的离解降低。 由于这一下降,强和弱酸混合物的 pH 值只能从强酸的浓度中计算。 例如,具有同等浓度的氢氯酸 (HCl) ,强酸和弱酸的甲酸 (HCHO2) 的混合物的 pH 值只能从浓度的氢氯酸确定。 如果混合物中 HCl 的浓度为 0.0020 M ,则其 pH 值可按以下公式计算。
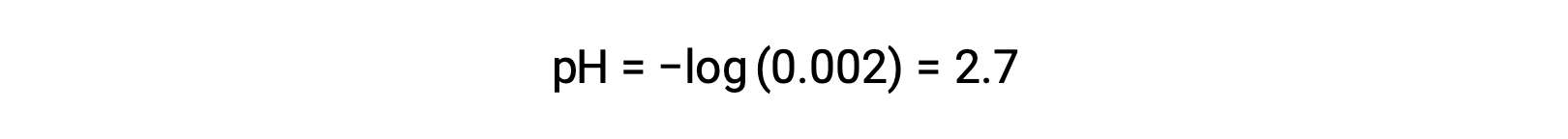
在这里,由 HCA2 和水的自电离生产的水合氢离子浓度可以忽略不计,因此可以忽略。
两个弱酸与不同解离常数的混合
在两种弱酸混合物中,如果混合物的解离常数明显高于弱酸,混合物的 pH 值将由强酸确定。 例如,如果混合物中的氮酸 (HNO2) 和次氯酸 (HCLO) 的浓度相等,则 HNO2 将是混合物 pH 的主要决定因素,因为其 Ka (4.6 × 10−4) 大约比 HCLO 的 Ka (2.9 × 10−8) 高 10,000 倍。 根据勒查特勒的原则, HCLO 在 HNO2的存在下显示离解下降。
