15.9:
Mélanges d'acides
15.9:
Mélanges d'acides
Le pH d’une solution contenant un acide peut être déterminé en utilisant sa constante de dissociation acide et sa concentration initiale. Si une solution contient deux acides différents, son pH peut être déterminé à l’aide d’une des méthodes suivantes, selon la force relative des acides et leurs constantes de dissociation.
Un mélange d’un acide fort et d’un acide faible
Dans le mélange d’un acide fort et d’un acide faible, l’acide fort se dissocie totalement et devient la source de presque tous les ions hydronium présents dans la solution. En revanche, l’acide faible révèle une dissociation partielle et produit une concentration négligeable d’ions hydronium. L’importante concentration d’ions hydronium produite par l’acide fort réduit davantage la dissociation de l’acide faible. Cela se produit parce que, selon le principe de Le chatelier : “ lorsqu’un système chimique à l’équilibre est perturbé, le système se déplace dans le sens qui minimise la perturbation “. L’excès d’ions hydronium produit par l’acide fort perturbe l’équilibre, et donc la réaction se déplace dans le sens inverse jusqu’à ce que l’équilibre soit établi. Cela entraîne une diminution de la dissociation de l’acide faible. En raison de cette diminution, un pH d’un mélange d’acide fort et faible peut être calculé à partir de la concentration de l’acide fort seulement. Par exemple, le pH d’un mélange ayant des concentrations égales d’acide chlorhydrique (HCl), un acide fort, et d’acide formique (HCHO2), un acide faible, peut être déterminé à partir de la concentration d’HCl uniquement. Si la concentration d’HCl dans le mélange est de 0,0020 M, son pH peut être calculé comme suit.
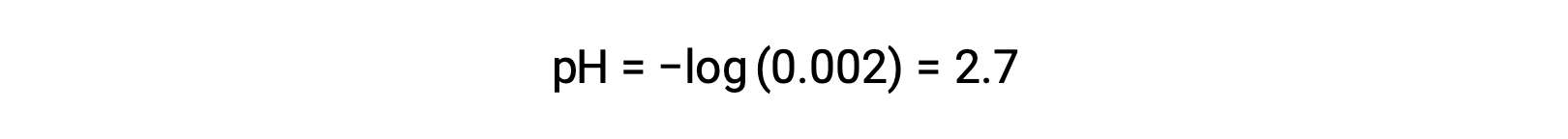
Ici, la concentration des ions hydronium produits par HCHO2 et l’auto-ionisation de l’eau est négligeable et peut donc être ignorée.
Un mélange de deux acides faibles avec des constantes de dissociation différentes
Dans un mélange de deux acides faibles, le pH d’un mélange sera déterminé par l’acide le plus fort si sa constante de dissociation est significativement plus élevée que l’acide le plus faible. Par exemple, dans un mélange ayant une concentration égale d’acide nitreux (HNO2) et d’acide hypochloreux (HClO), le HNO2 sera le principal déterminant du pH du mélange car son Ka (4,6 × 10−4) est environ 10 000 fois plus élevé que le Ka (2,9 × 10−8) de HClO. D’après le principe de Le Chatelier, HClO révèle une dissociation plus faible en présence de HNO2.
