15.12:
Ácidos Polipróticos
15.12:
Ácidos Polipróticos
Os ácidos são classificados pelo número de protões por molécula que podem doar em uma reação. Ácidos como HCl, HNO3, e HCN que contêm um átomo de hidrogénio ionizável em cada molécula são chamados ácidos monopróticos. As suas reações com água são:
| Ácidos monopróticos: Reações com água |
| HCl (aq) + H2O (l) ⟶ H3O+ (aq) + Cl− (aq) |
| HNO3 (aq) + H2O (l) ⟶ H3O+ (aq) + NO3− (aq) |
| HCN (aq) + H2O (l) ⇌ H3O+ (aq) + CN− (aq) |
Embora contenha quatro átomos de hidrogénio, o ácido acético, CH3CO2H, é também monoprótico, porque apenas o átomo de hidrogénio do grupo carboxilo (COOH) reage com bases:
De forma semelhante, bases monopróticas são bases que aceitam um único protão.
Os ácidos dipróticos contêm dois átomos de hidrogénio ionizáveis por molécula; a ionização desses ácidos ocorre em dois passos. A primeira ionização ocorre sempre em maior medida do que a segunda ionização. Por exemplo, o ácido sulfúrico, um ácido forte, ioniza da seguinte forma:
| Ácido diprótico: Ácido sulfúrico (H2SO4) | ||
| 1a ionização | H2SO4 (aq) + H2O (l) ⇌ H3O+ (aq) + HSO4− (aq) | Ka1 = mais de 102; dissociação completa |
| 2a ionização | HSO4− (aq) + H2O (l) ⇌ H3O+ (aq) + SO42− (aq) | Ka2 = 1,2 × 10−2 |
Este processo de ionização por passos ocorre para todos os ácidos polipróticos. O ácido carbónico, H2CO3, é um exemplo de um ácido diprótico fraco. A primeira ionização do ácido carbónico produz iões hidrónio e iões bicarbonato em pequenas quantidades.
Primeira ionização: H2CO3 (aq) + H2O (l) ⇌ H3O+ (aq) + HCO3− (aq)
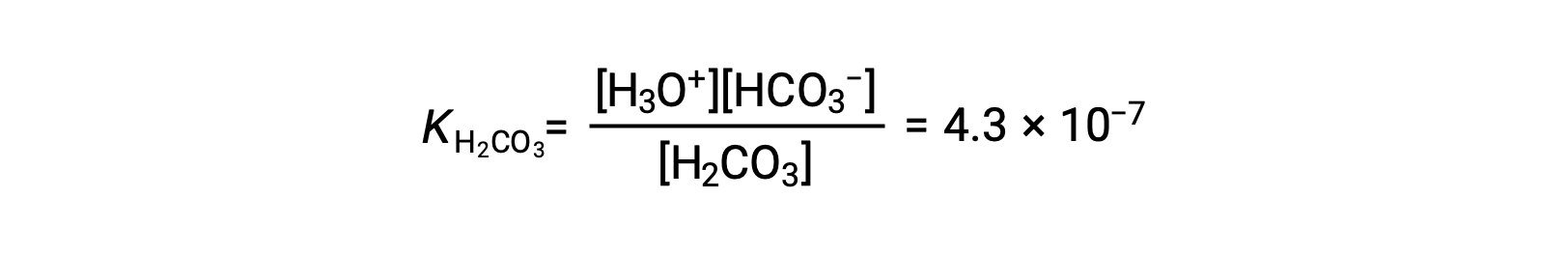
O ião bicarbonato também pode funcionar como um ácido. Ele ioniza e forma iões hidrónio e iões carbonato em quantidades ainda mais pequenas.
Segunda ionização: HCO3− (aq) + H2O (l) ⇌ H3O+ (aq) + CO32− (aq)
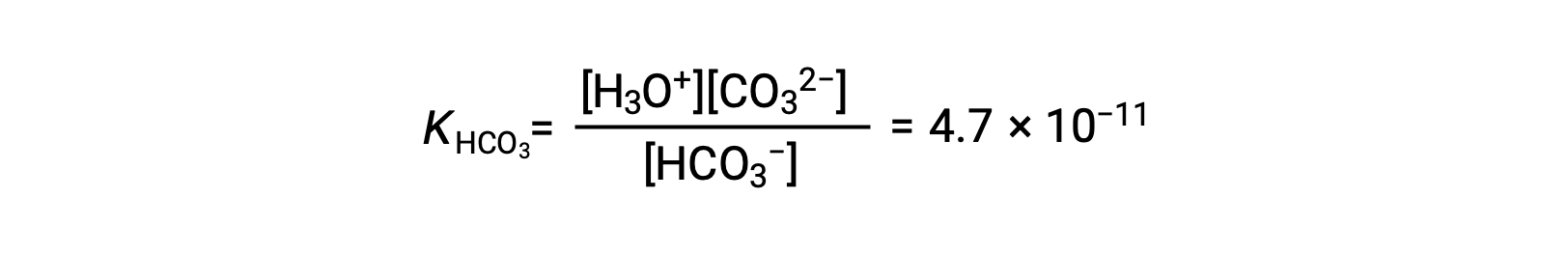
KH2CO3 é maior que KHCO3− por um factor de 104, pelo que H2CO3 é o produtor dominante de iões hidrónio na solução. Isto significa que pouco do HCO3− formado pela ionização de H2CO3 ioniza para dar iões hidrónio (e iões carbonato), e as concentrações de H3O+ e HCO3− são praticamente iguais em uma solução aquosa pura de H2CO3.
Se a primeira constante de ionização de um ácido diprótico fraco for superior à segunda por um factor de pelo menos 20, é adequado tratar a primeira ionização separadamente e calcular as concentrações que dela resultam antes de calcular as concentrações de espécies resultantes da ionização subsequente. Esta abordagem é demonstrada no seguinte exemplo de exercício.
Ionização de um Ácido Diprótico
A “água com gás” contém uma quantidade aceitável de dióxido de carbono dissolvido. A solução é ácida porque o CO2 reage com a água para formar ácido carbónico, H2CO3. Quais são [H3O+], [HCO3−], e [CO32−] em uma solução saturada de CO2 com uma inicial [H2CO3] = 0,033?
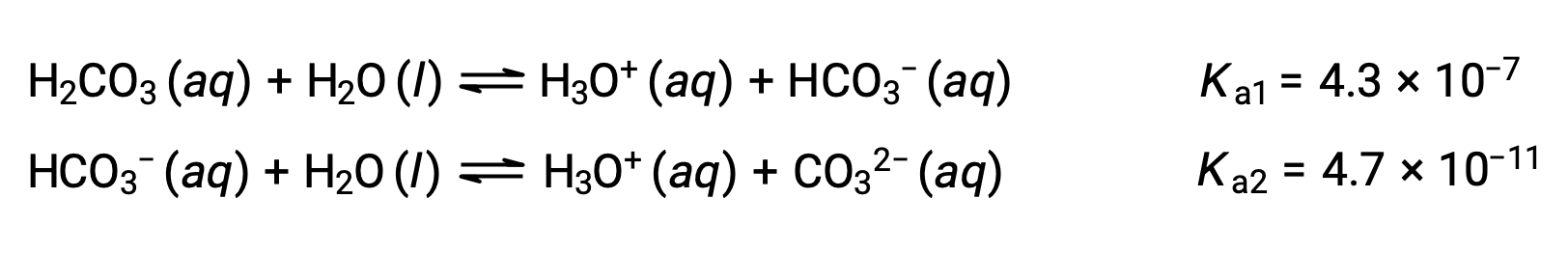
Como indicado pelas constantes de ionização, H2CO3 é um ácido muito mais forte do que HCO3−, portanto as reações de ionização por passos podem ser tratadas separadamente. Usando as informações fornecidas, uma tabela ICE para este primeiro passo de ionização é preparada:
| H2CO3 (aq) | H3O+ (aq) | HCO3− (aq) | |
| Concentração inicial (M) | 0,033 | ~0 | 0 |
| Alteração (M) | −x | +x | +x |
| Concentração em equilíbrio (M) | 0,033 − x | x | x |
Substituindo as concentrações de equilíbrio na equação de equilíbrio obtemos
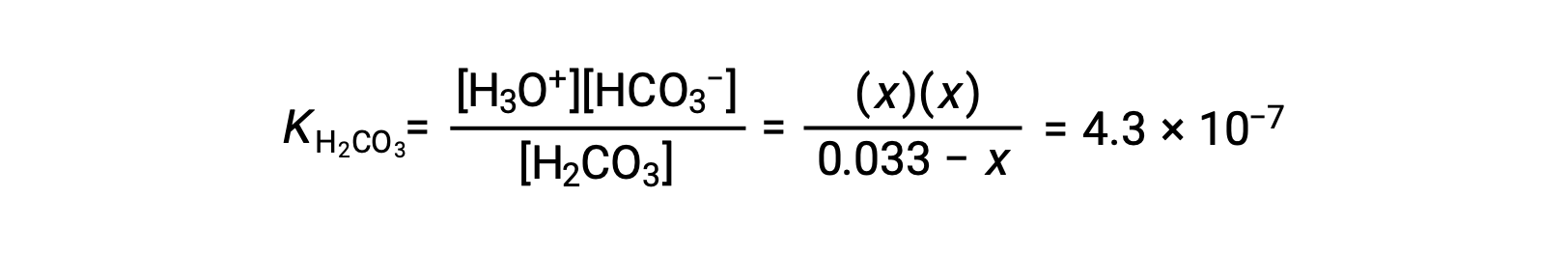
Assumindo que x << 0,033 e resolvendo a equação simplificada obtemos
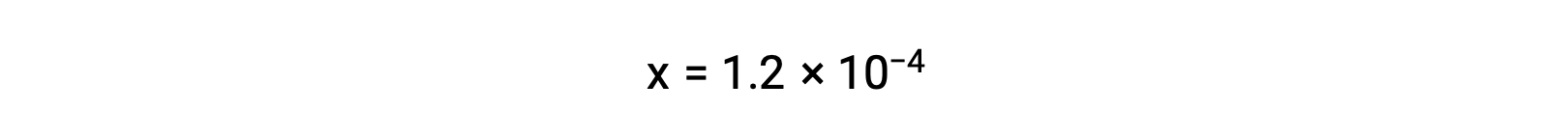
A tabela ICE definiu x como sendo igual à molaridade de iões bicarbonato e à molaridade de iões hidrónio:
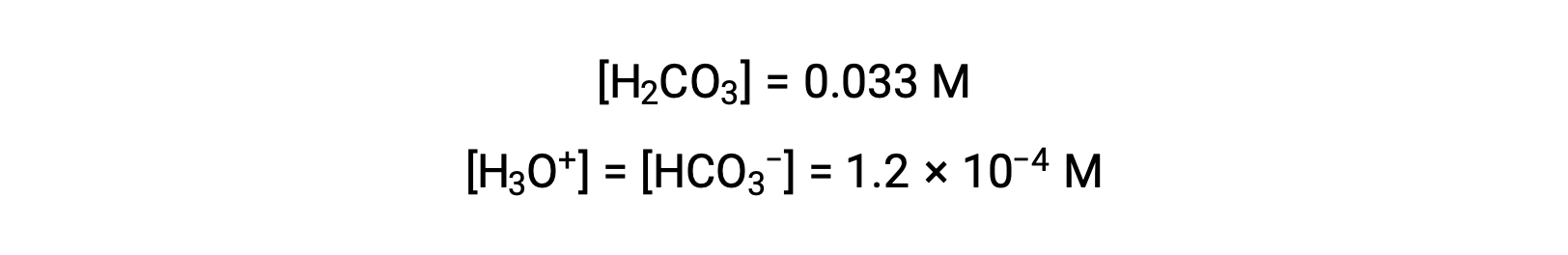
Utilizando a concentração de iões bicarbonato acima calculada, a segunda ionização é submetida a um cálculo de equilíbrio semelhante: HCO3− (aq) + H2O (l) ⇌ H3O+ (aq) + CO32− (aq)
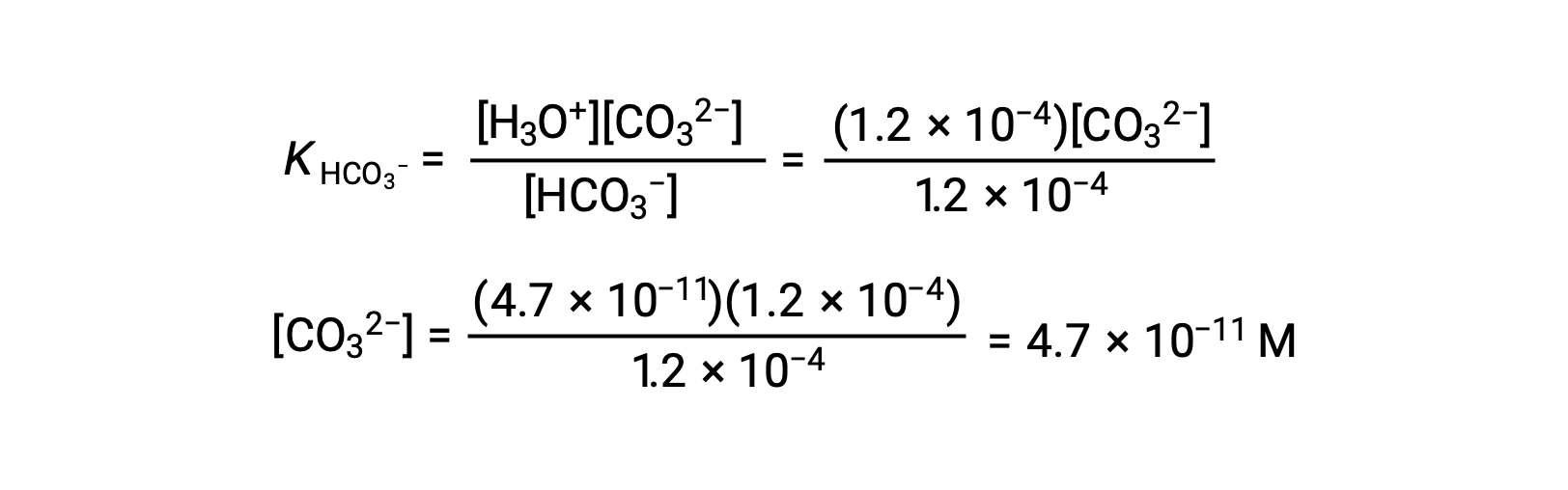
Resumindo: em equilíbrio [H2CO3] = 0,033 M; [H3O+] = 1,2 × 10−4; [HCO3−] = 1,2 × 10−4 M; e [CO32−] = 4,7 × 10−11 M.
Um ácido triprótico é um ácido que tem três átomos de H ionizáveis. O ácido fosfórico é um exemplo:
| Ácido Triprótico: Ácido fosfórico (H3PO4) | ||
| 1a ionização | H3PO4 (aq) + H2O (l) ⇌ H3O+ (aq) + H2PO4− (aq) | Ka1 = 7,5 × 10−3 |
| 2a ionização | H2PO4− (aq) + H2O (l) ⇌ H3O+ (aq) + HPO42− (aq) | Ka2 = 6,2 × 10−8 |
| 3a ionização | HPO42− (aq) + H2O (l) ⇌ H3O+ (aq) + PO43− (aq) | Ka3 = 4,2 × 10−13 |
Como para os exemplos de ácidos dipróticos, cada reação de ionização sucessiva é menos extensa do que a primeira, refletida em valores decrescentes para as constantes de ionização acídica por passos. Esta é uma característica geral dos ácidos polipróticos e as constantes de ionização sucessivas diferem muitas vezes por um factor de cerca de 105 a 106.
Este conjunto de três reações de dissociação pode parecer complicar os cálculos das concentrações de equilíbrio em uma solução de H3PO4. No entanto, como as constantes de ionização sucessivas diferem por um factor de 105 a 106, existem grandes diferenças nas pequenas alterações na concentração que acompanham as reações de ionização. Isso permite o uso de suposições e processos que simplificam a matemática, como demonstrado nos exemplos acima. As bases polipróticas são capazes de aceitar mais de um ião hidrogénio. O ião carbonato é um exemplo de uma base diprótica, porque pode aceitar dois protões, como mostrado abaixo. Semelhante ao caso dos ácidos polipróticos, observe que as constantes de ionização diminuem com o passo de ionização. Da mesma forma, os cálculos de equilíbrio envolvendo bases polipróticas seguem as mesmas abordagens que os dos ácidos polipróticos.
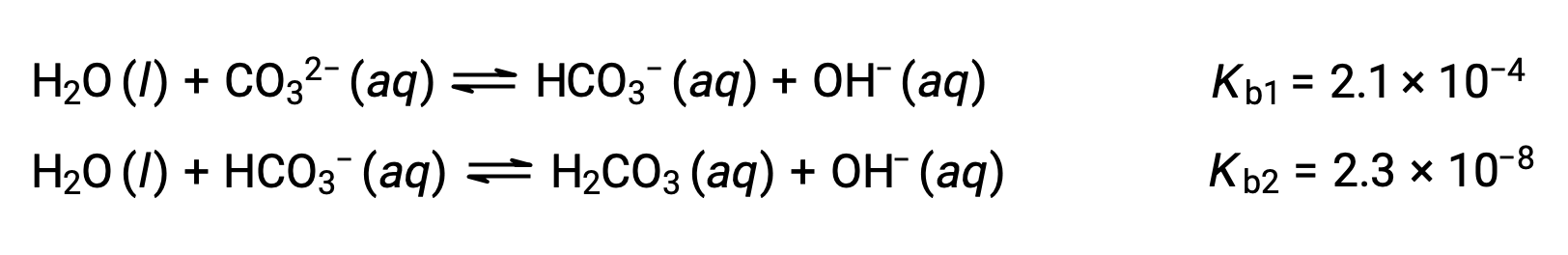
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.5: Polyprotic Acids.
