16.6:
滴定计算:强酸 - 强碱
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Titration Calculations: Strong Acid – Strong Base
当用强碱滴定强酸或反过来滴定时,整个滴定过程中的 pH 值 可通过测定剩余的水合氢离子 或氢氧化物离子的浓度来计算。例如,50 毫升 0.10M 的盐酸 分解成 0.10M 的水合氢离子和氯离子,初始 pH 值为 1。如果加入 25 毫升的 0.10M 氢氧化钠,新的水合氢离子浓度可以 通过从水合氢离子的总摩尔数中减去 氢氧化物离子的总摩尔数 并除以总体积来计算—75 毫升或 0.075 升。50 毫升 0.10M 的盐酸含有 0.0050 摩尔的水合氢离子,而 25 毫升 0.10M 的 氢氧化钠含有 0.0025 摩尔的氢氧化物离子。将这些值代入方程式,得到水合氢离子的浓度等于 0.033M。因此,溶液的 pH 值上升到 1.48。如果继续添加氢氧化钠 至 50 毫升,则盐酸中 的所有水合氢离子 均被中和,达到等值点,此时 pH 值上升至 7。在等值点以上,溶液的 pH 值 由氢氧化物离子决定,因为盐酸已被完全中和。如果向溶液中加入 70 毫升含有 0.0070M 氢氧化物离子的氢氧化钠溶液,氢氧化物离子的最终浓度可以 通过从氢氧化物离子的总摩尔数中减去 水合氢离子的初始摩尔数并除以 溶液的总体积来确定。由于最终的氢氧化物离子浓度为 0.017M,溶液的 pOH 和 pH 值分别等于 1.78 和 12.22。
16.6:
滴定计算:强酸 - 强碱
计算滴定溶液的 pH 值:强酸 / 强碱
对 25.00 mL 0.100 M HCL (强酸) 和 0.100 M 的强碱 NaOH 进行滴定。 添加碱溶液的不同体积的 pH 值可按以下公式计算:
(A) 滴液体积 = 0 mL。 溶液 pH 值是由 HCl 的酸电离引起的。 因为这是一个强酸,电离是完整的,水合氢离子体积摩尔浓度是 0.100 M。 溶液的 pH 值是:

(B) 滴液体积 = 12.50 mL。 由于酸样品和碱滴定剂都是一丙酮并均匀浓缩,因此这种滴定添加剂包括小于 A 化学化学数量 of 碱,因此通过与样品中过量酸的反应将其完全消耗。 剩余酸的浓度通过从初始数量中减去消耗的数量然后除以溶液体积来计算:
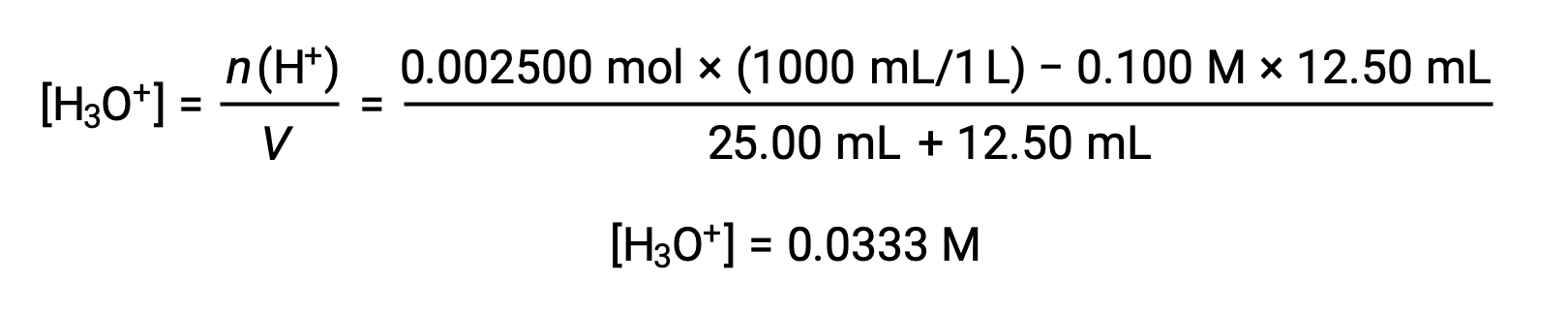
(C) 滴液体积 = 25.00 mL。 这种滴定添加剂涉及碱的化学化学当量数量 (等效点) ,因此只有中和反应的生成物在溶液 (水和 NaCl) 中。 该盐的阳离子和阴离子均不会发生 酸-碱 电离;生成水合氢离子的唯一过程是水的自质解。 溶液为中性, pH 值 =7.00。
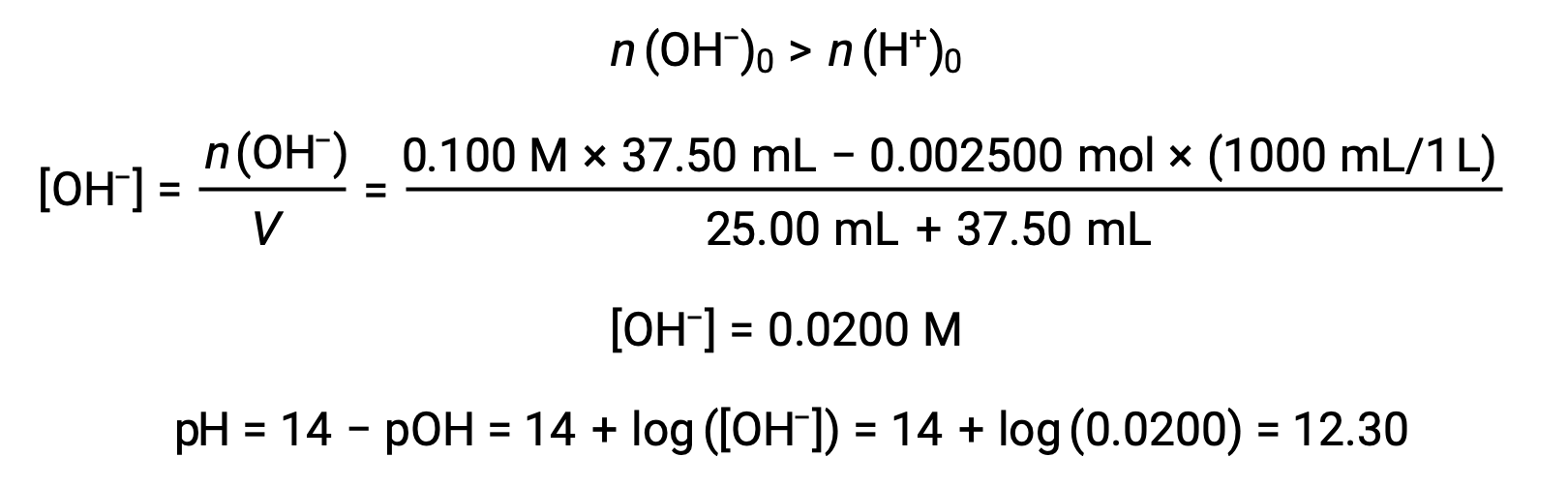
(d) 滴液体积 = 37.50 mL。 这涉及添加超过等效点的滴定。 然后使用氢氧化物离子的浓度计算溶液 pH 值: