16.6:
Cálculos de Titulación: Ácido Fuerte - Base Fuerte
16.6:
Cálculos de Titulación: Ácido Fuerte - Base Fuerte
Cálculo del pH para soluciones de titulación: Ácido fuerte/base fuerte
Se realiza una titulación de 25,00 ml de HCl 0,100 M (ácido fuerte) con 0,100 M de una base fuerte NaOH. El pH, a diferentes volúmenes de solución básica añadida, puede calcularse de la siguiente manera:
(a) Volumen de titulante = 0 ml. El pH de la solución se debe a la ionización ácida del HCl. Debido a que se trata de un ácido fuerte, la ionización es completa y la molaridad de iones hidronio es de 0,100 M. El pH de la solución es entonces:

(b) Volumen de titulante = 12,50 ml. Dado que la muestra de ácido y la base titulante son monopróticos y están presentes en igual concentración, esta adición de titulante implica menos de una cantidad estequiométrica de base, por lo que se consume completamente mediante reacción con el exceso de ácido en la muestra. La concentración de ácido restante se calcula restando la cantidad consumida de la cantidad inicial y dividiendo por el volumen de la solución:
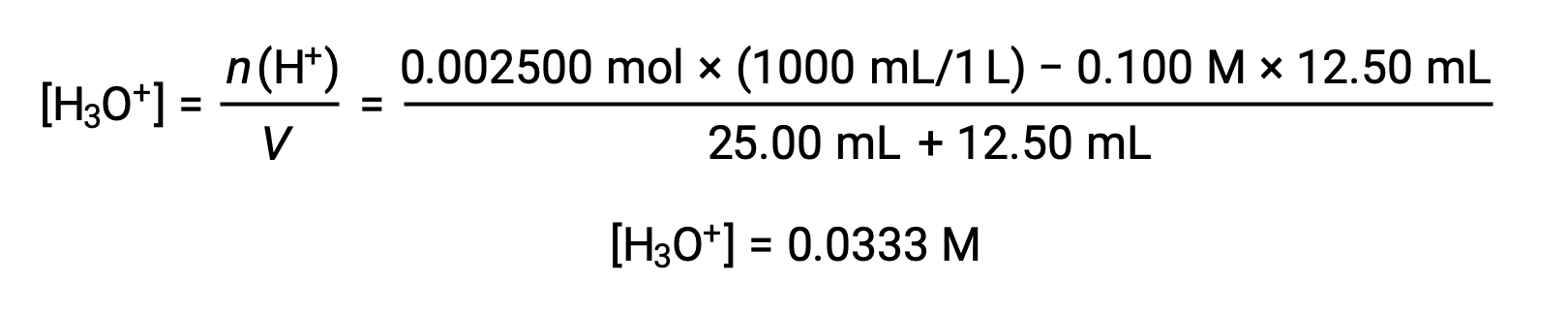
(c) Volumen de titulante = 25,00 ml. Esta adición de titulante implica una cantidad estequiométrica de base (el punto de equivalencia), por lo que sólo los productos de la reacción de neutralización están en solución (agua y NaCl). Ni el catión ni el anión de esta sal se someten a ionización ácido-base; el único proceso que genera iones hidronio es la autoprotólisis del agua. La solución es neutra, con un pH = 7,00.
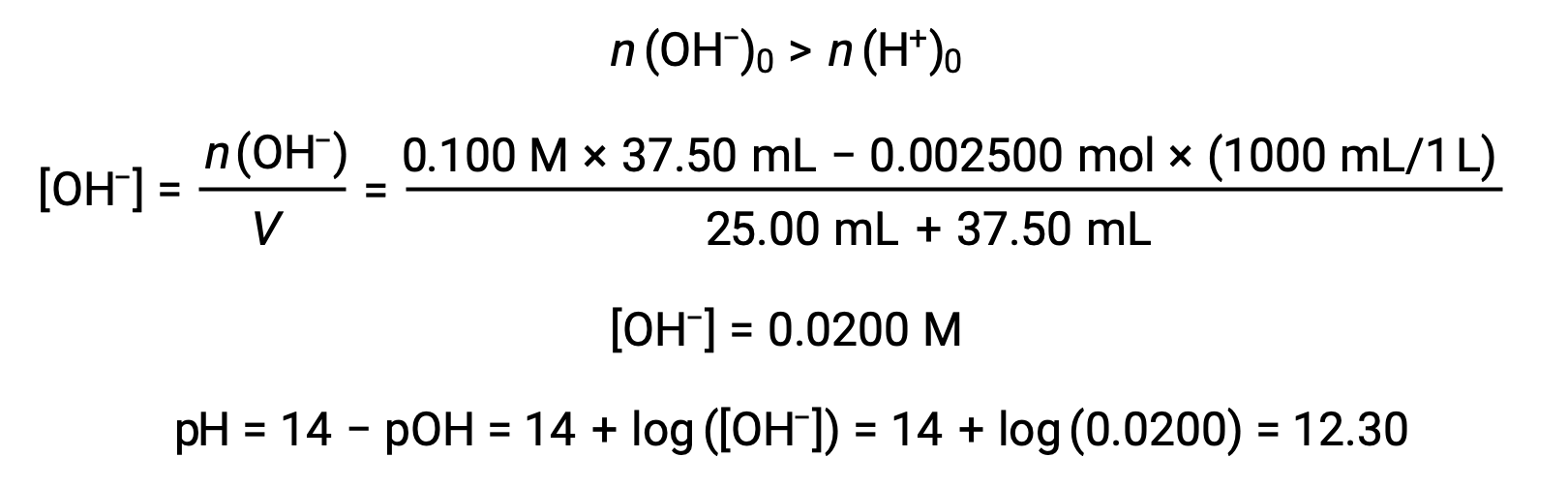
(d) Volumen de titulante = 37,50 ml. Esto implica la adición de titulante por encima del punto de equivalencia. A continuación, el pH de la solución se calcula utilizando la concentración de iones hidróxido:
Este texto es adaptado de Openstax, Química 2e, Sección 14.7: Titulaciones ácido-base.
