16.6:
حسابات المعايرة: حمض قوي-قاعدة قوية
16.6:
حسابات المعايرة: حمض قوي-قاعدة قوية
حساب الرقم الهيدروجيني لحلول المعايرة: حمض قوي / قاعدة قوية
يتم إجراء معايرة لـ 25.00 مل من 0.100 مول HCl (حمض قوي) مع 0.100 مول من NaOH قاعدة قوية. يمكن حساب الرقم الهيدروجيني بأحجام مختلفة من محلول القاعدة المضاف على النحو التالي:
(أ) حجم المعايِر = 0 مل. يرجع محلول الأس الهيدروجيني إلى التأين الحمضي لـ HCl. لأن هذا حمض قوي، يكون التأين كاملاً ويكون مولارية أيون الهيدرونيوم 0.100 مول. ثم يكون الرقم الهيدروجيني للمحلول:

(ب) حجم المعاير = 12.50 مل. نظرًا لأن العينة الحمضية والمعايرة القاعدية كلاهما أحادي النوع ومركّز بشكل متساوٍ، فإن إضافة المعاير هذه تتضمن أقل من كمية متكافئة من القاعدة، وبالتالي يتم استهلاكها تمامًا عن طريق التفاعل مع الحمض الزائد في العينة. يتم حساب تركيز الحمض المتبقي عن طريق طرح الكمية المستهلكة من الكمية الأولية ثم القسمة على حجم المحلول:
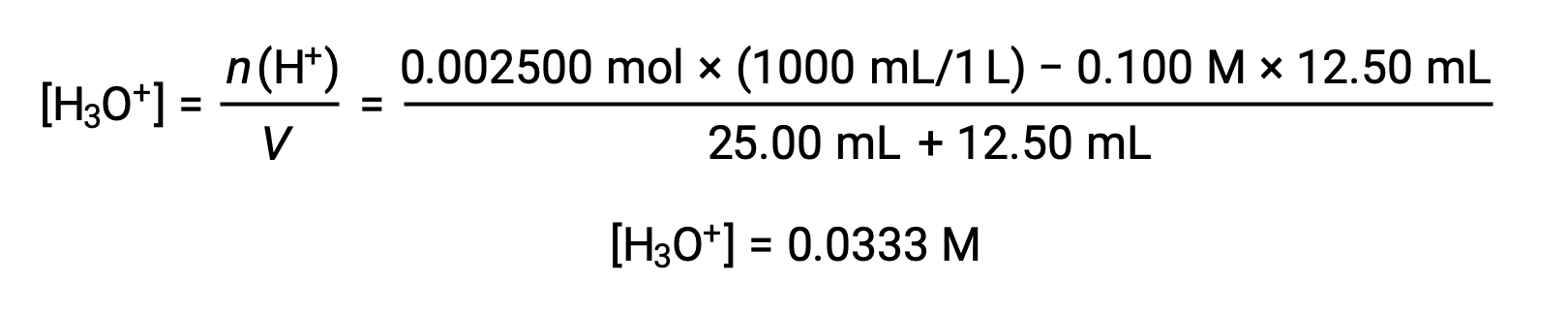
(ج) حجم المعاير = 25.00 مل. تتضمن إضافة المعايرة هذه كمية متكافئة من القاعدة (نقطة التكافؤ) ، وبالتالي فإن منتجات تفاعل المعادلة هي فقط في المحلول (الماء وكلوريد الصوديوم). لا يخضع الكاتيون ولا أنيون هذا الملح لتأين حمض-قاعدة؛ العملية الوحيدة لتوليد أيونات الهيدرونيوم هي التحلل الذاتي للماء. المحلول متعادل، وله أس هيدروجيني = 7.00.
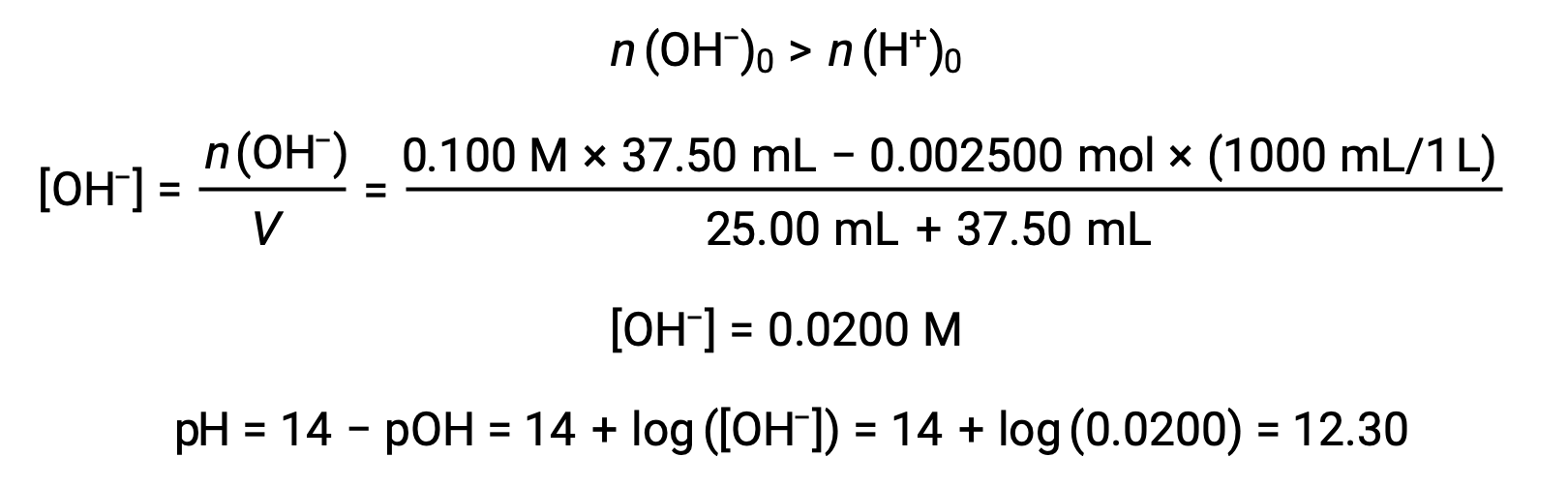
(د) حجم المعاير = 37.50 مل. هذا ينطوي على إضافة المعاير بما يزيد عن نقطة التكافؤ. ثم يتم حساب الرقم الهيدروجيني للمحلول باستخدام تركيز أيون الهيدروكسيد:
هذا النص مقتبس من Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.
