16.6:
적정 계산: 강산 - 강염기
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Titration Calculations: Strong Acid – Strong Base
강산을 강염기로 적정화하거나 그 반대인 경우 적정화 전체의 pH는 남은 하이드로늄 또는 수산화 이온의 농도를 측정하여 계산할 수 있습니다. 예를 들어 0.10 몰의 염산 50밀리리터는 0.10 몰 하이드로늄과 염화물 이온으로 해리되며 이 때 초기 pH는 1입니다. 0.10 몰의 수산화나트륨 25 밀리리터를 첨가하면 새로운 수소 이온 농도는 총 몰의 히드로늄이온 이온에서 총 몰의 수산화물을 빼고 75 밀리리터 또는 0.075리터의 총 부피로 나누어 계산할 수 있습니다.0.10 몰의 염산 50밀리리터에는 0.0050 몰의 하이드로늄이 들어 있고 0.10몰의 수산화나트륨 25밀리리터에는 0.0025 몰의 수산화물 이온이 들어 있습니다. 이 값들을 방정식에 대입하면 하이드로늄 이온 농도는 0.033 몰과 같습니다. 따라서 솔루션의 pH는 1.48로 상승했습니다.수산화나트륨을 50밀리리터까지 첨가하면 염산의 모든 하이드로늄 이온은 중화되며 pH가 7로 상승할 때 당량점에 도달합니다. 당량점 이상에서 용액의 pH는 염산이 완전히 중화되었기 때문에 수산화 이온에 의해 결정됩니다. 0.0070몰의 수산화물 이온을 포함하는 수산화나트륨 용액 70밀리리터를 용액에 첨가하면 수산화물 이온의 최종 농도는 수산화물 이온의 총 몰에서 히드로늄이온의 초기 몰 수를 빼고 용액의 총 부피로 나누어 계산할 수 있습니다.최종 수산화물 이온 농도는 0.017 몰이므로 용액의 pOH와 pH는 각각 1.78과 12.22입니다.
16.6:
적정 계산: 강산 - 강염기
적정 용 용 pH 계산 : 강한 산 / 강한 기지
적층은 0.100 M HCl(강한 산)의 25.00 mL에 대해 0.100 M의 강한 염기 NaOH를 수행한다. 추가된 기본 솔루션의 다양한 볼륨에서 pH는 다음과 같이 계산할 수 있습니다.
(a) 적대물 = 0mL. 용액 pH는 HCl의 산 이온화 때문입니다. 이것은 강한 산이기 때문에, 이온화가 완료되고 하이드로늄 이온 어모함은 0.100 M이다. 솔루션의 pH는 다음과 같습니다.

(b) 적대물 = 12.50 mL. 산 시료와 베이스 티란트는 단보틱하고 동등하게 농축되기 때문에, 이 적정 첨가는 염기의 배양 이하를 수반하므로 시료내의 과잉 산과의 반응에 의해 완전히 소모된다. 남은 산의 농도는 초기 양에서 소비된 양을 빼고 용액 부피로 나누어 계산됩니다.
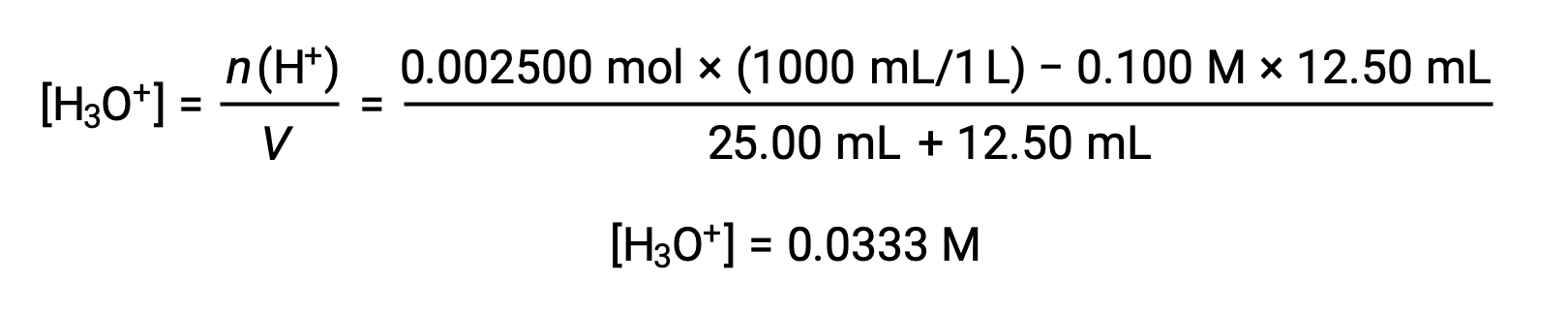
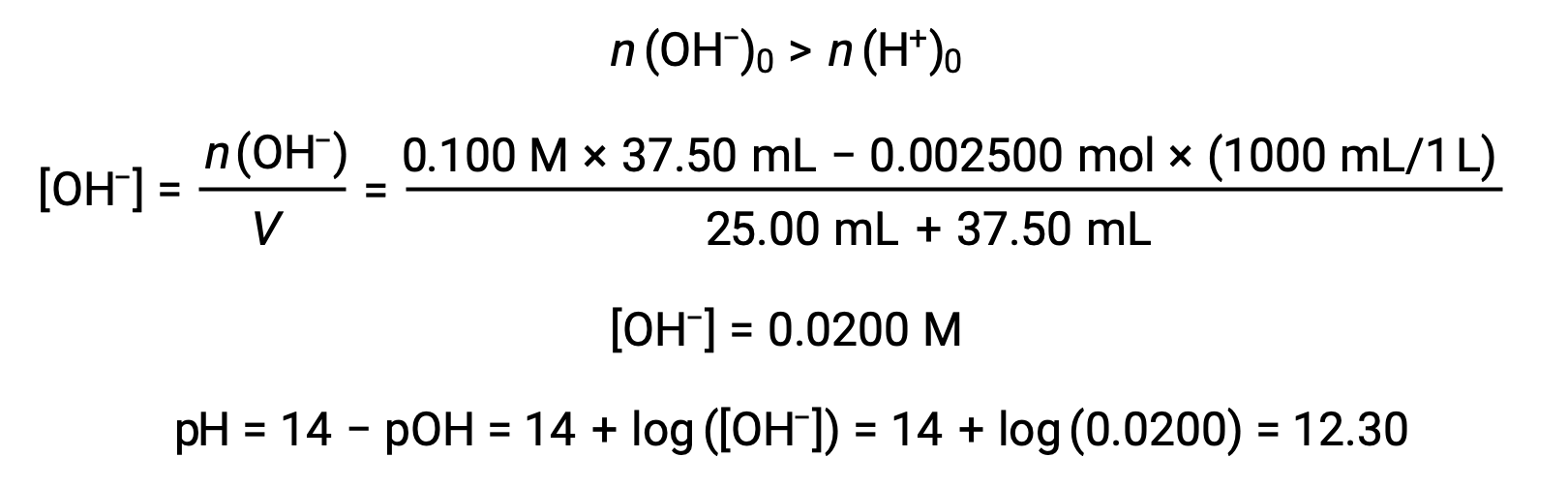
(c) 적대물 = 25.00 mL. 이러한 적신은 방사능 적정량의 염기(등가점)를수반하므로 중화 반응의 제품만이 용액(물과 NaCl)에 있다. 이 염의 양이온이나 애니온은 산염 이온화를 거치지 않습니다. 하이드로늄 이온을 생성하는 유일한 공정은 물의 자동 발화입니다. 솔루션은 pH = 7.00을 갖는 중립입니다.
(d) 적대물 = 37.50 mL. 이것은 등가 점을 초과하는 적성의 추가를 관련시킵니다. 그런 다음 용액 pH는 수산화 이온의 농도를 사용하여 계산됩니다.