16.7:
Cálculos de Titulação: Ácido Fraco - Base Forte
16.7:
Cálculos de Titulação: Ácido Fraco - Base Forte
Cálculo do pH para Soluções de Titulação: Ácido Fraco/Base Forte
Para a titulação de 25,00 mL de CH3CO2H a 0,100 M com NaOH a 0,100 M, a reação pode ser representada como:
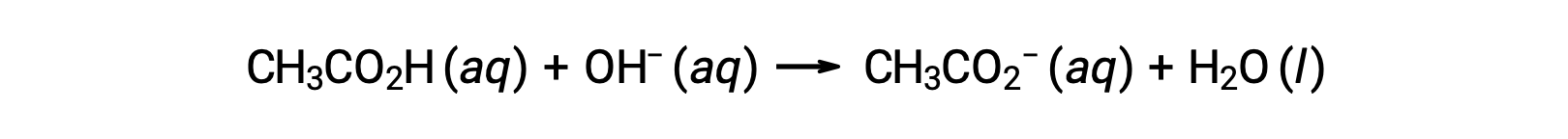
O pH da solução de titulação após a adição dos diferentes volumes de solução titulante de NaOH pode ser calculado da seguinte forma:
(a) O pH inicial é calculado para a solução de ácido acético na abordagem ICE habitual:
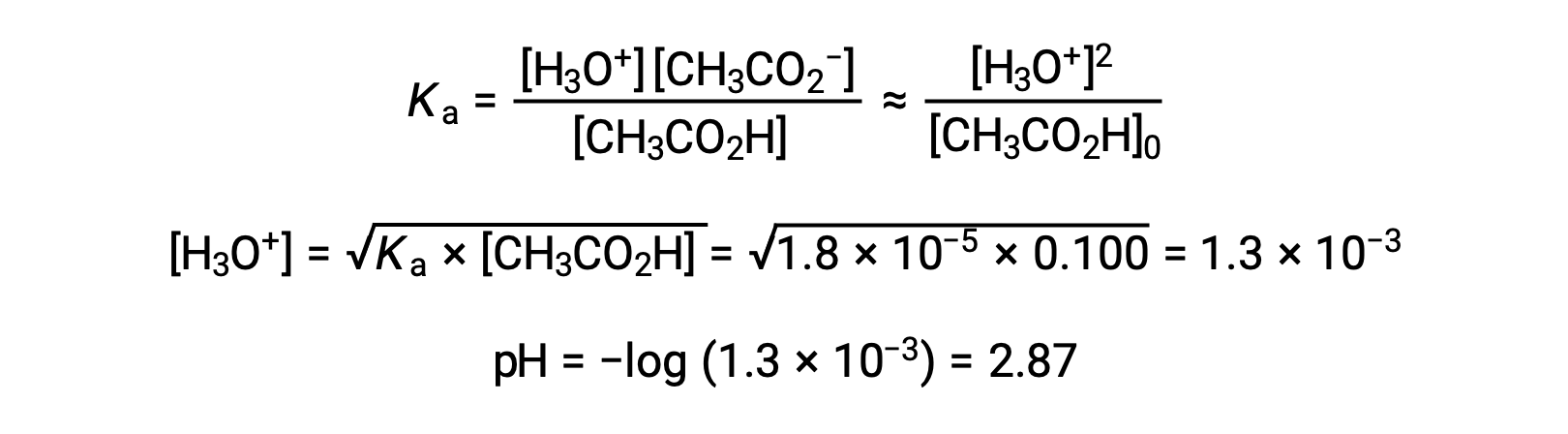
(b) O ácido e o titulante são ambos monopróticos e as soluções de amostra e titulante estão igualmente concentradas; assim, este volume de titulante representa o ponto de equivalência. Ao contrário do exemplo de ácido forte, a mistura de reação neste caso contém uma base de conjugado fraca (acetato iónico). O pH da solução é calculado considerando a ionização básica do acetato, que está presente em uma concentração de
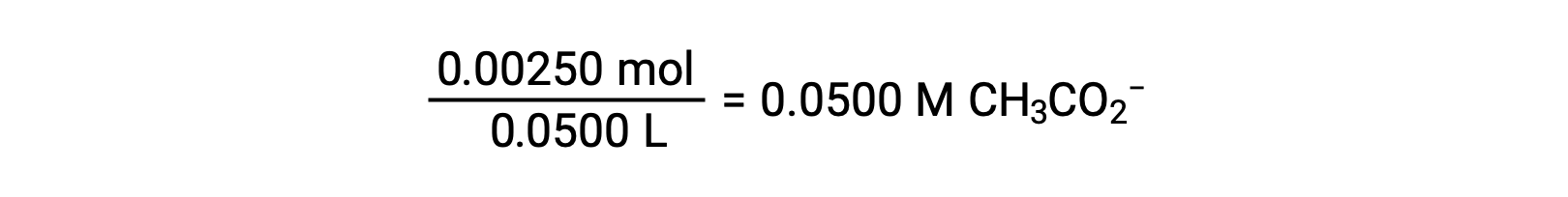
A ionização básica do acetato é representada pela equação
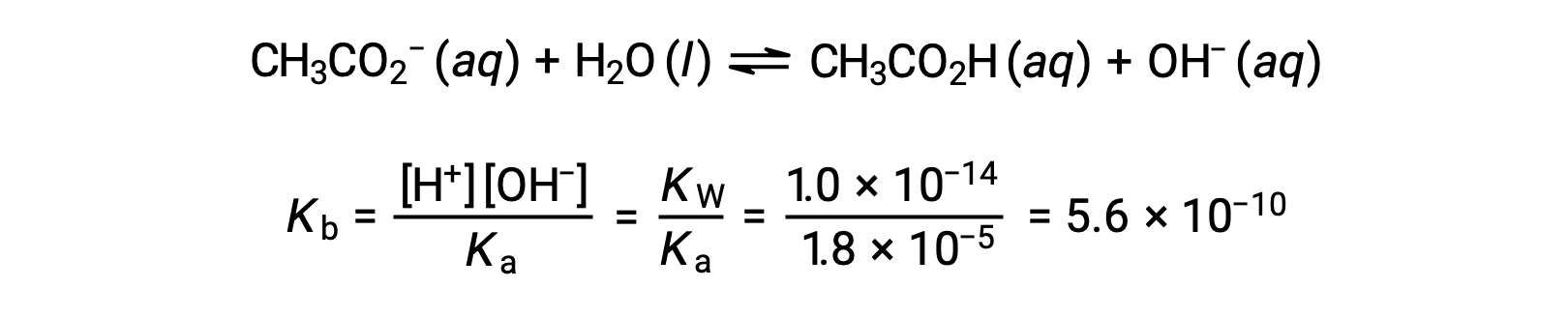
Assumindo que x << 0,0500, o pH pode ser calculado através da abordagem ICE habitual:
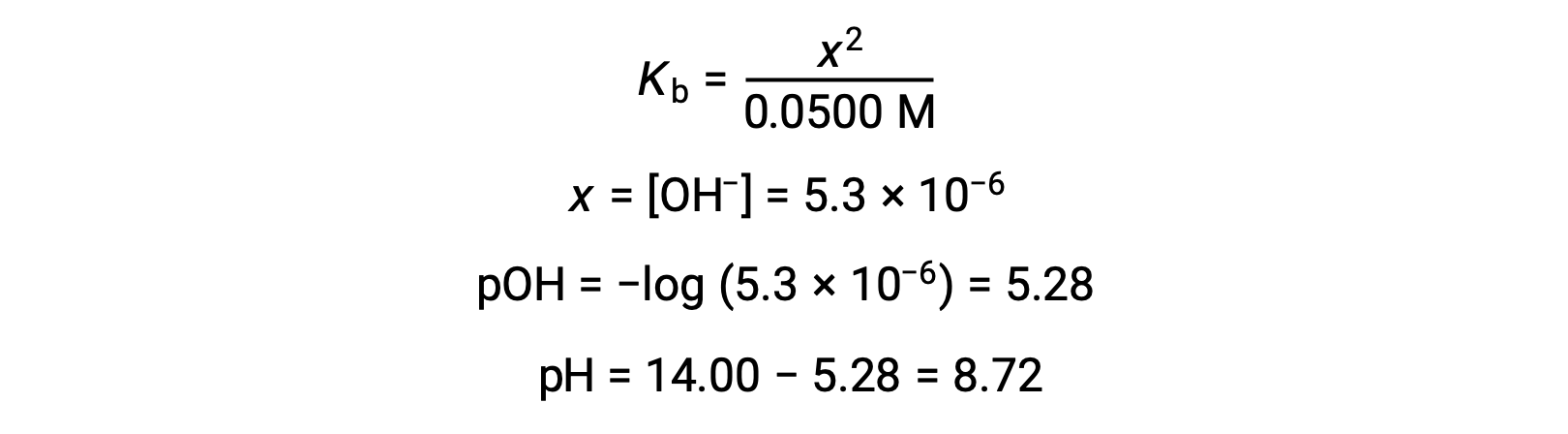
Tenha em atenção que o pH no ponto de equivalência desta titulação é significativamente superior a 7, conforme esperado quando se titula um ácido fraco com uma base forte.
(c) Volume de titulante = 12,50 mL. Este volume representa metade da quantidade estequiométrica de titulante, pelo que metade do ácido acético foi neutralizada para produzir uma quantidade equivalente de ião acetato. As concentrações desses pares conjugados ácido-base são, portanto, iguais. Uma abordagem conveniente para o cálculo do pH é o uso da equação de Henderson-Hasselbalch:
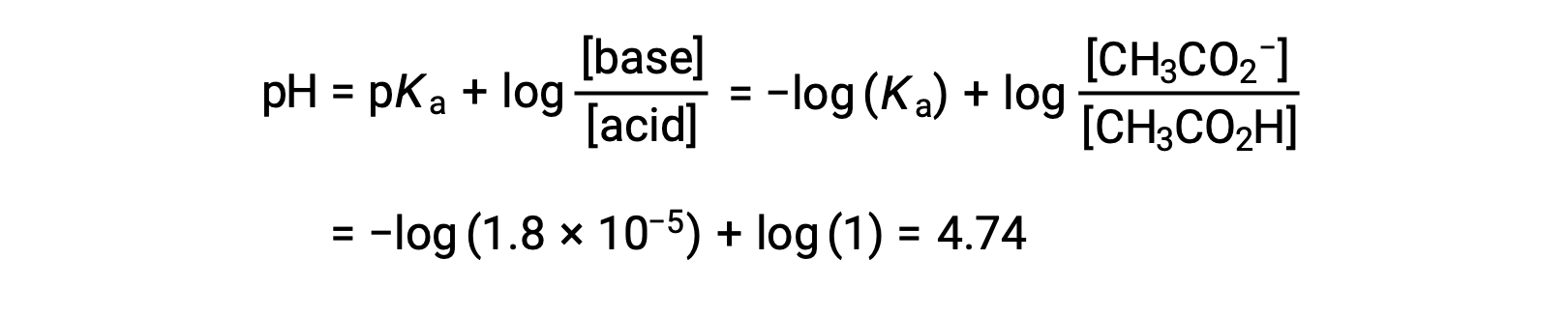
(pH: pKa no ponto de meia equivalência em uma titulação de um ácido fraco)
(d) Volume de titulante = 37,50 mL. Este volume representa um excesso estequiométrico de titulante, e uma solução de reação que contém tanto o produto de titulação, iões acetato, como o titulante forte em excesso. Em tais soluções, o pH da solução é determinado principalmente pela quantidade da base forte em excesso:

Este texto é adaptado de Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.
