16.8: Titration Calculations: Weak Acid - Strong Base
Calculating pH for Titration Solutions: Weak Acid/Strong Base
For the titration of 25.00 mL of 0.100 M CH3CO2H with 0.100 M NaOH, the reaction can be represented as:
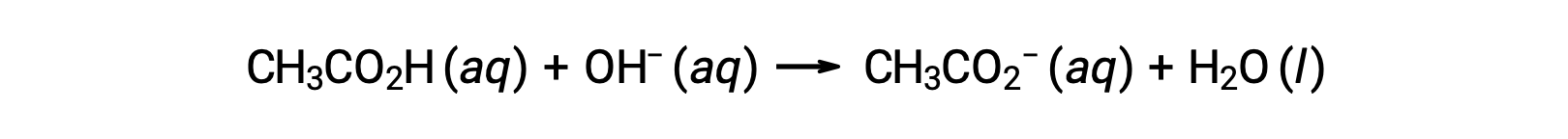
The pH of the titration solution after the addition of the different volumes of NaOH titrant can be calculated as follows:
(a) The initial pH is computed for the acetic acid solution in the usual ICE approach:
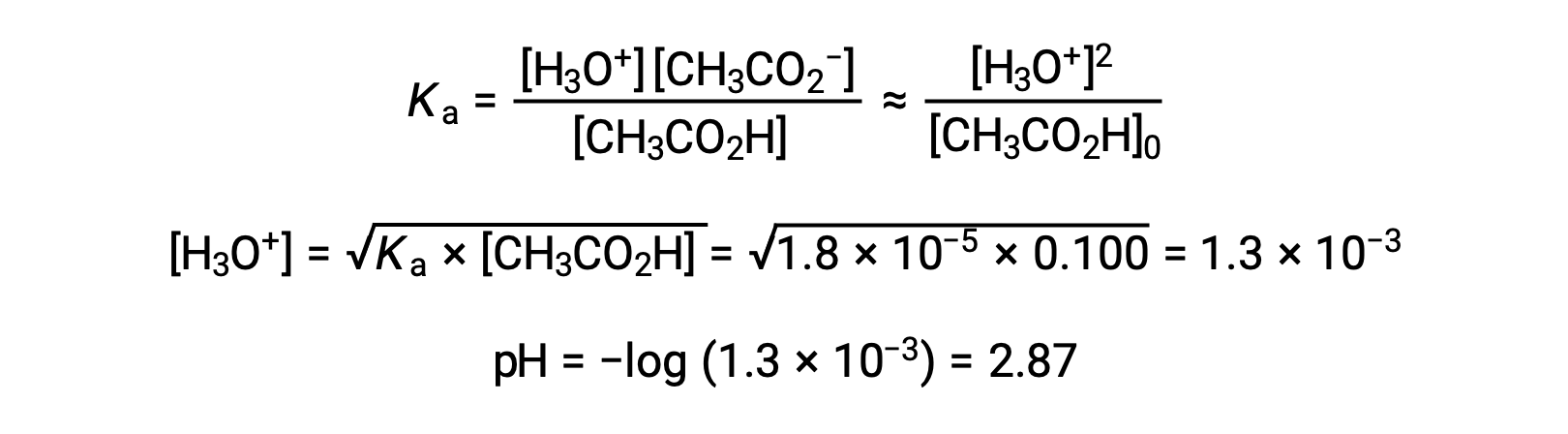
(b) The acid and titrant are both monoprotic and the sample and titrant solutions are equally concentrated; thus, this volume of titrant represents the equivalence point. Unlike the strong-acid example, the reaction mixture in this case contains a weak conjugate base (acetate ion). The solution pH is computed considering the base ionization of acetate, which is present at a concentration of
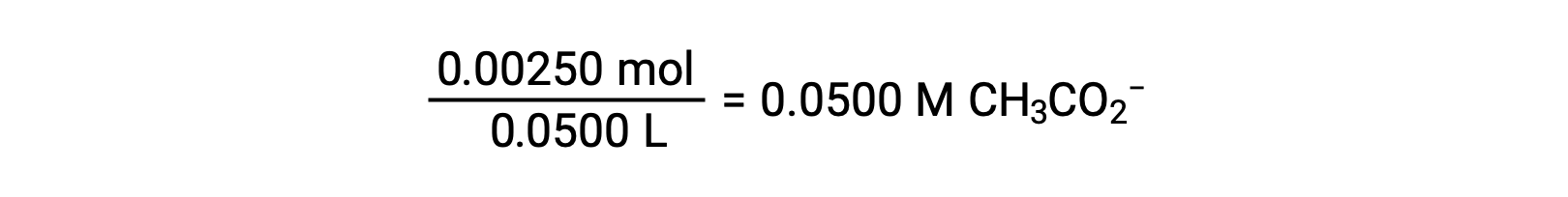
Base ionization of acetate is represented by the equation
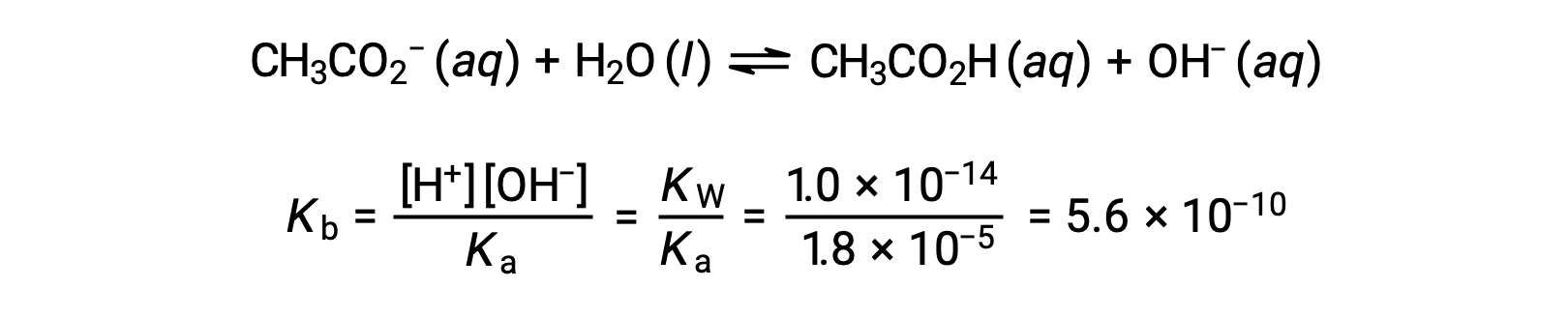
Assuming x << 0.0500, the pH may be calculated via the usual ICE approach:
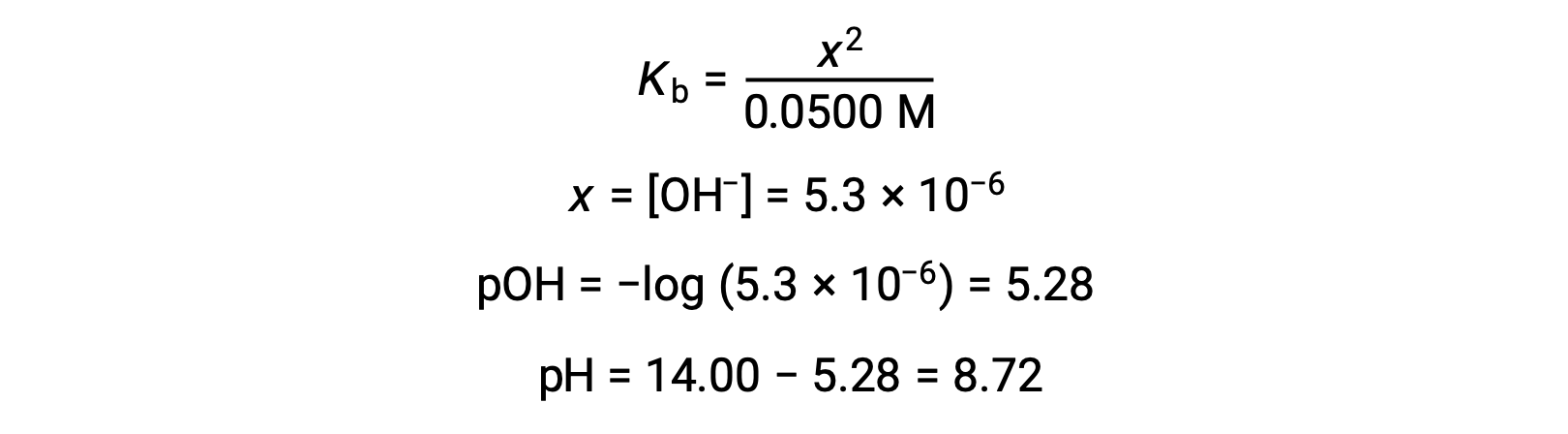
Note that the pH at the equivalence point of this titration is significantly greater than 7, as expected when titrating a weak acid with a strong base.
(c) Titrant volume = 12.50 mL. This volume represents one-half of the stoichiometric amount of titrant, and so one-half of the acetic acid has been neutralized to yield an equivalent amount of acetate ion. The concentrations of these conjugate acid-base partners, therefore, are equal. A convenient approach to computing the pH is use of the Henderson-Hasselbalch equation:
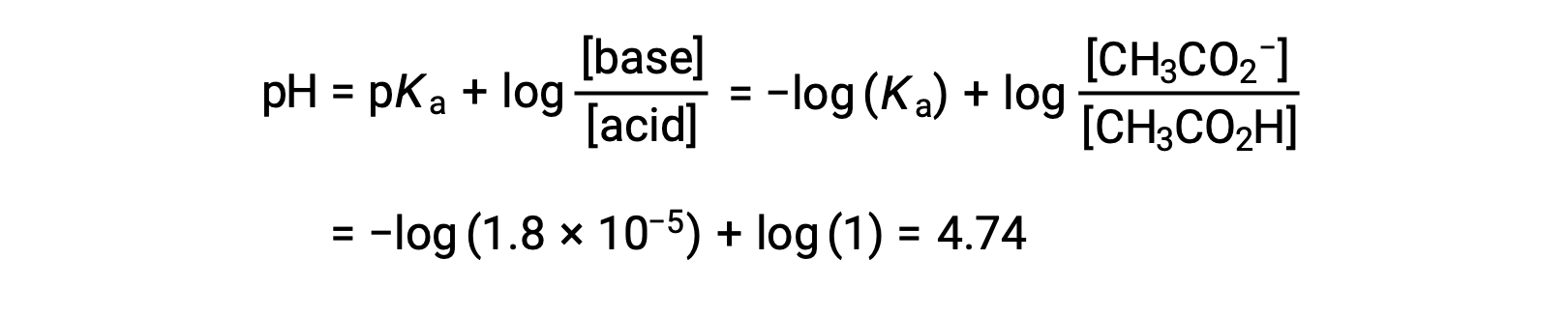
(pH = pKa at the half-equivalence point in a titration of a weak acid)
(d) Titrant volume = 37.50 mL. This volume represents a stoichiometric excess of titrant, and a reaction solution containing both the titration product, acetate ion, and the excess strong titrant. In such solutions, the solution pH is determined primarily by the amount of excess strong base:

This text is adapted from Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.


