16.7:
Calcoli di titolazione: acido debole - base debole
16.7:
Calcoli di titolazione: acido debole - base debole
Calcolo del pH per le soluzioni di titolazione: acido debole/ base forte
Per la titolazione di 25,00 mL di 0,100 M CH3CO2H con NaOH 0,100 M, la reazione può essere rappresentata come:
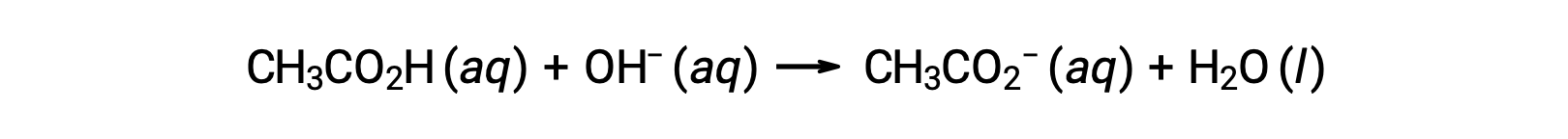
Il pH della soluzione di titolazione dopo l’aggiunta dei diversi volumi di titolazione NaOH può essere calcolato come segue:
(a) Il pH iniziale è calcolato per la soluzione di acido acetico nel solito approccio ICE:
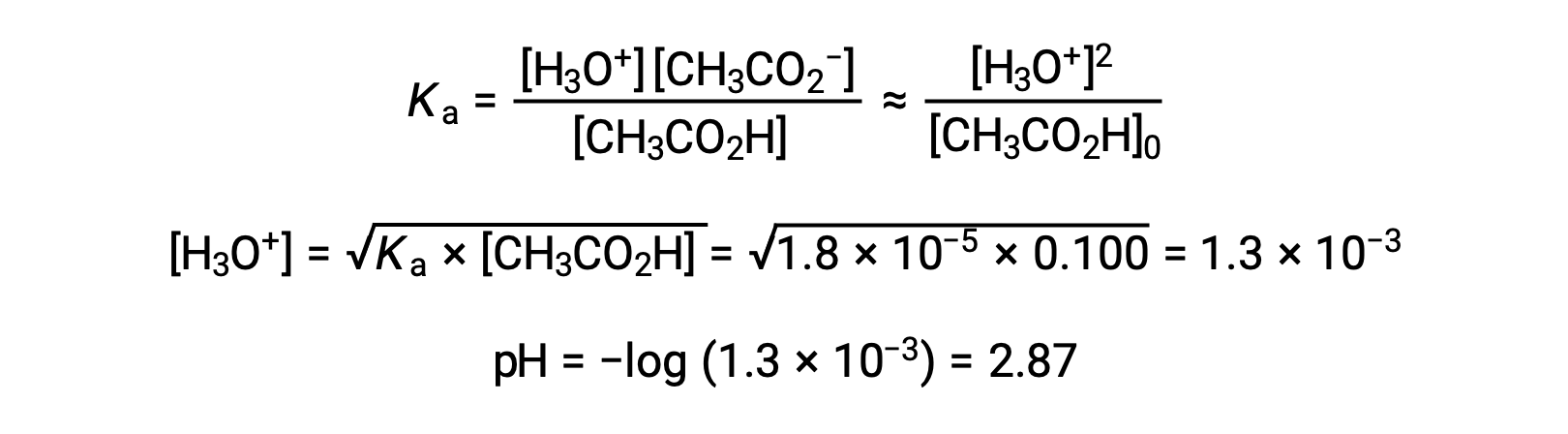
b L’acido e il titolazione sono sia monoprotici che le soluzioni campione e titolazione sono ugualmente concentrate; quindi, questo volume di titolazione rappresenta il punto di equivalenza. A differenza dell’esempio dell’acido forte, la miscela di reazione in questo caso contiene una base coniugata debole (ione acetato). Il pH della soluzione è calcolato considerando la ionizzazione di base dell’acetato, che è presente ad una concentrazione di
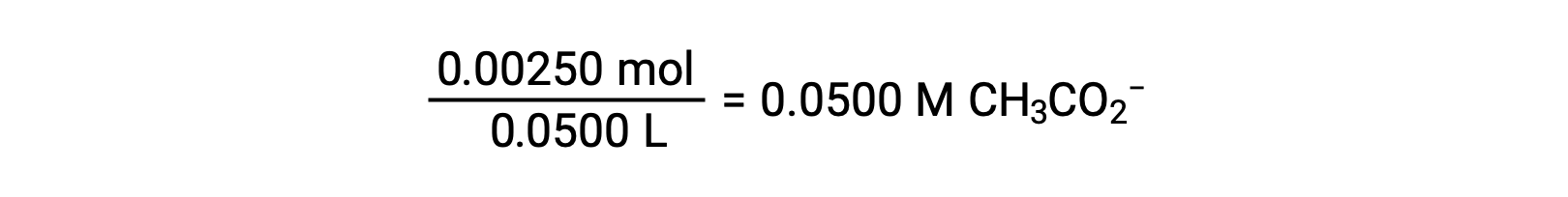
La ionizzazione di base dell’acetato è rappresentata dall’equazione
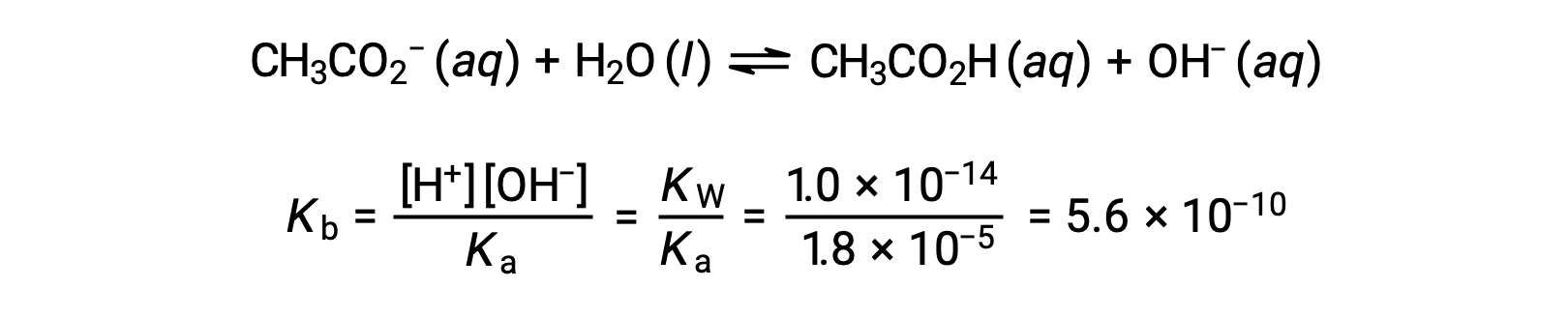
Supponendo x << 0,0500, il pH può essere calcolato tramite il consueto approccio ICE:
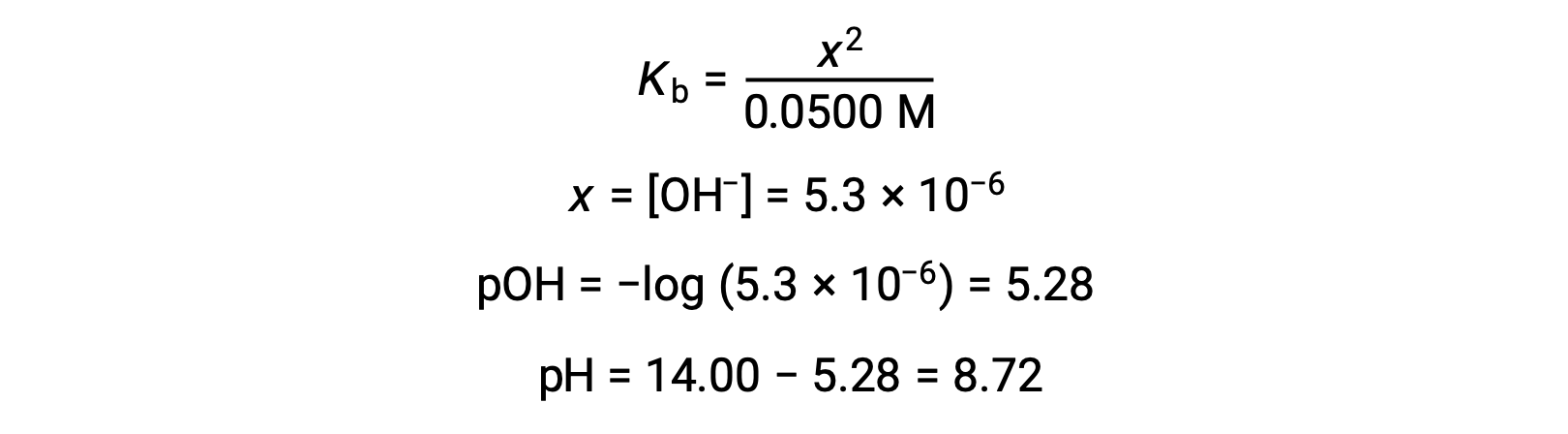
Si noti che il pH nel punto di equivalenza di questa titolazione è significativamente maggiore di 7, come previsto quando si titra un acido debole con una base forte.
(e) Volume titolato = 12,50 mL. Questo volume rappresenta la metà della quantità stechiometrica di titolazione, e quindi metà dell’acido acetico è stato neutralizzato per produrre una quantità equivalente di ione acetato. Le concentrazioni di questi partner coniugati acido-base, quindi, sono uguali. Un approccio conveniente al calcolo del pH è l’uso dell’equazione di Henderson-Hasselbalch:
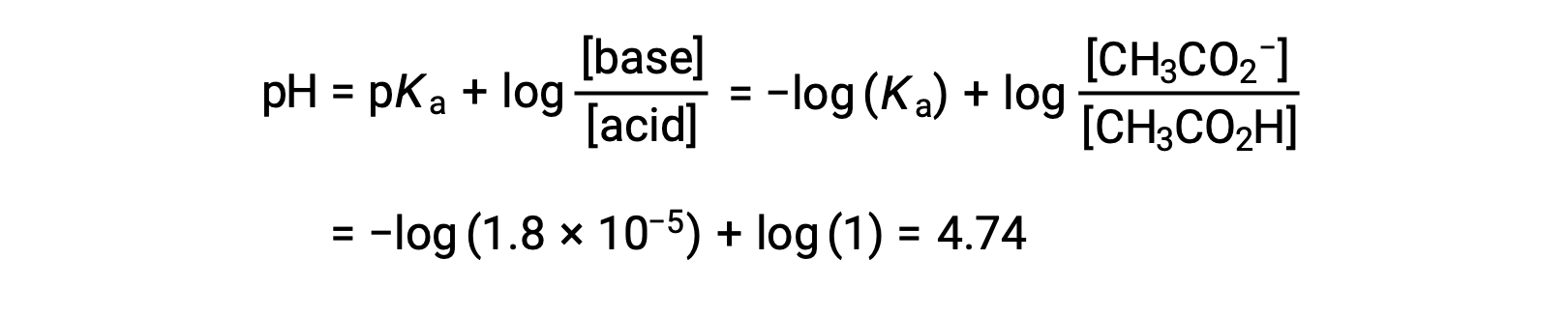
(pH = pKa nel punto di semi-equivalenza in una titolazione di un acido debole)
(d) Volume del titolazione = 37,50 mL. Questo volume rappresenta un eccesso stechiometrico di titolazione e una soluzione di reazione contenente sia il prodotto di titolazione, lo ione acetato, sia il titolazione forte in eccesso. In tali soluzioni, il pH della soluzione è determinato principalmente dalla quantità di base forte in eccesso:

Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.7: Titolazioni acido-base.
