17.2:
Entropía
17.2:
Entropía
Las partículas de sal que se han disuelto en el agua nunca se unen espontáneamente en solución para formar de nuevo las partículas sólidas. Además, un gas que se ha expandido en un vacío permanece disperso y nunca se reensambla espontáneamente. La naturaleza unidireccional de estos fenómenos es el resultado de una función de estado termodinámico llamada entropía (S). La entropía es la medida del grado de dispersión de la energía a través de un sistema, o en otras palabras, es proporcional al grado de desorden de un sistema termodinámico. La entropía puede aumentar (ΔS > 0, el desorden aumenta) o disminuir (ΔS < 0, el desorden disminuye) como resultado de los cambios físicos o químicos en el sistema. El cambio en la entropía es la diferencia entre la entropía de los estados final e inicial: ΔS = Sf – Si.
Teoría de los microestados de Boltzmann
Un microestado es una configuración específica de todas las ubicaciones y energías de los átomos o moléculas que componen un sistema. La relación entre la entropía de un sistema y el número de microestados posibles (W) es S = k lnW, donde k es la constante de Boltzmann, 1,38 × 10−23 J/K.
El cambio en la entropía es
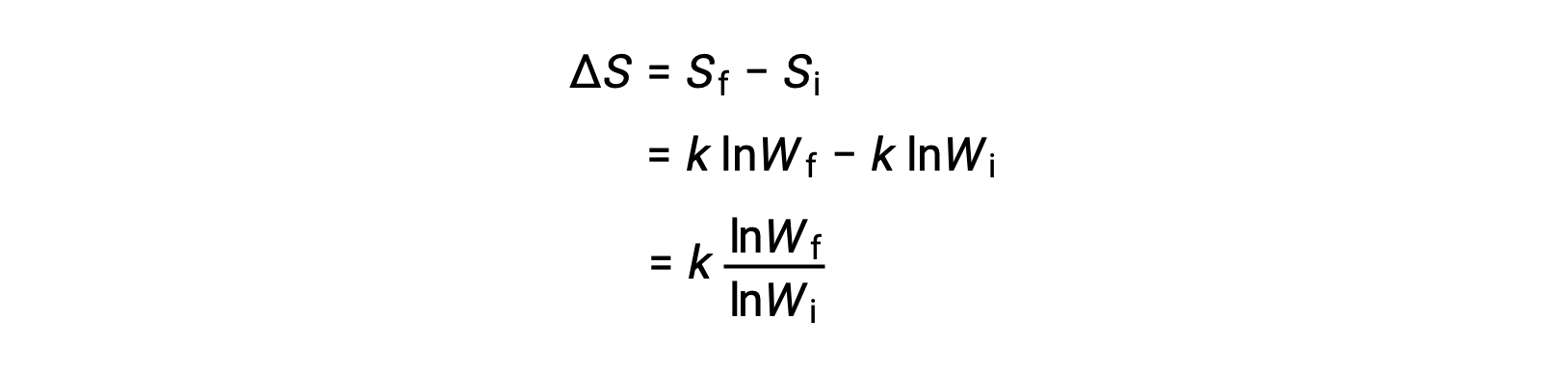
Un sistema que tiene un mayor número de microestados posibles está más desordenado (entropía más alta) que un sistema ordenado (entropía más baja) con un menor número de microestados. Para los procesos que implican un aumento en el número de microestados,Wf > Wi, la entropía del sistema aumenta y #916;S > 0. Por el contrario, los procesos que reducen el número de microestados, Wf < Wi, producen una disminución en la entropía del sistema, ΔS < 0.
Considere la distribución de un gas ideal entre dos matraces conectados. Inicialmente, las moléculas de gas se limitan a uno de los dos matraces. La apertura de la válvula entre los matraces aumenta el volumen disponible para las moléculas de gas (la energía se dispersa más a través de un dominio mayor) y, en consecuencia, aumenta también el número de microestados posibles para el sistema. Debido a que Wf > Wi, el proceso de expansión implica un aumento de entropía (ΔS > 0) y es espontáneo.
Se puede utilizar un enfoque similar para describir el flujo espontáneo de calor. Una taza de té caliente dispersa uniformemente su energía sobre un mayor número de partículas de aire en la sala más fría, lo que resulta en un mayor número de microestados.
Generalizaciones sobre la Entropía
Las relaciones entre la entropía, los microestados y la dispersión de materia/energía permiten generalizaciones respecto a la entropía relativa de las sustancias y predecir el signo de los cambios de entropía para los procesos químicos y físicos.
En la fase sólida, los átomos o moléculas están restringidos a posiciones casi fijas con respecto a los demás y son capaces de oscilaciones modestas sobre estas posiciones. Por lo tanto, el número de microestados es relativamente pequeño. En la fase líquida, los átomos o moléculas son libres de moverse uno sobre y alrededor del otro, aunque permanecen en la proximidad relativamente cercana uno al otro. Por lo tanto, el número de microestados es proporcionalmente mayor que para un sólido. Como resultado, Slíquido > Ssólido y el proceso de convertir una sustancia de sólido a líquido (fusión) se caracteriza por un aumento de la entropía, ΔS > 0. Por el mismo razonamiento, el proceso recíproco (congelación) muestra una disminución en la entropía, ΔS < 0.
En la fase gaseosa, un número dado de átomos o moléculas ocupan un volumen mucho mayor que la fase líquida, correspondiendo a un número mucho mayor de microestados. Por consiguiente, para cualquier sustancia, la Sgas > Slíquido > Ssólido y los procesos de vaporización y sublimación también implican aumentos en la entropía, ΔS > 0. Asimismo, las transiciones de fase recíprocas—condensación y deposición—implican disminuciones en la entropía, ΔS < 0.
Según la teoría cinético-molecular, la temperatura de una sustancia es proporcional a la energía cinética promedio de sus partículas. El aumento de la temperatura de una sustancia dará lugar a vibraciones más extensas de las partículas en los sólidos y a traslaciones más rápidas de las partículas en los líquidos y gases. A temperaturas más altas, la distribución de la energía cinética entre los átomos o moléculas de la sustancia también está más dispersa que a temperaturas más bajas. Así, la entropía de cualquier sustancia aumenta con la temperatura.
La entropía de una sustancia es influenciada por la estructura de las partículas (átomos o moléculas) que componen la sustancia. Con respecto a las sustancias atómicas, los átomos más pesados poseen mayor entropía a una temperatura dada que los átomos más ligeros, lo que es consecuencia de la relación entre la masa de una partícula y el espaciamiento de los niveles de energía translacional cuantizados. Para las moléculas, un mayor número de átomos aumenta el número de formas en que las moléculas pueden vibrar y, por tanto, aumenta el número de microestados posibles y la entropía del sistema.
Finalmente, las variaciones en los tipos de partículas afectan la entropía de un sistema. En comparación con una sustancia pura, en la que todas las partículas son idénticas, la entropía de una mezcla de dos o más tipos de partículas diferentes es mayor. Esto es debido a las orientaciones e interacciones adicionales que son posibles en un sistema formado por componentes no idénticos. Por ejemplo, cuando un sólido se disuelve en un líquido, las partículas del sólido experimentan una mayor libertad de movimiento e interacciones adicionales con las partículas de disolvente. Esto corresponde a una dispersión más uniforme de la materia y la energía así como a un mayor número de microestados. El proceso de disolución, por lo tanto, implica un aumento en la entropía, ΔS > 0.
Este texto es adaptado de Openstax, Química 2e, Capítulo 16.2:Entropía.
