17.2:
Энтропия
17.2:
Энтропия
Частицы соли, растворенные в воде, никогда не возвращаются в раствор спонтанно, чтобы преобразоваться твердые частицы. Более того, газ, который расширяется в вакууме, остается рассеянным и никогда не спонтанно переассемблере. Однонаправленная природа этих явлений является результатом термодинамической функции состояния, называемой энтропией (S). Энтропия — это мера степени рассеяания энергии по всей системе, или, другими словами, она пропорциональна степени беспорядка термодинамической системы. Энтропия может либо увеличиваться (ΔS > 0, расстройства увеличиваются), либо уменьшаться (ΔS < 0, расстройства уменьшаются) в результате физических или химических изменений в системе. Изменение энтропии — это разница между энтропиями конечных и исходных состояний: ΔS = SF — Si.
Теория микросостояний Больцмана
Микросостояние — это конкретная конфигурация всех местоположений и энергий атомов или молекул, которые составляют систему. Отношение между энтропией системы и числом возможных микросостояний (W) — S = k ln W, где k — константа Больцмана, 1.38 × 10-23 J/K.
Изменение энтропии составляет
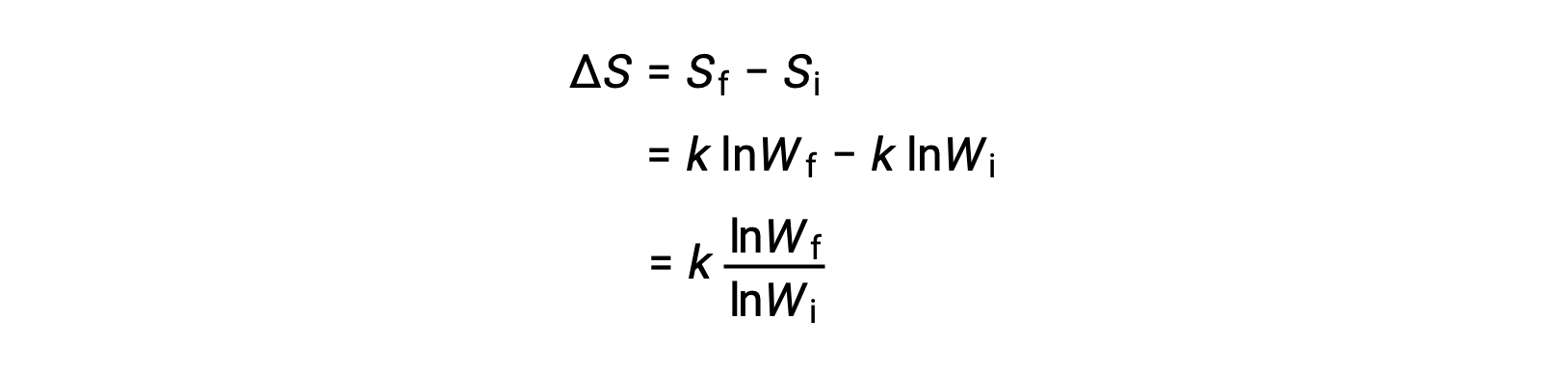
Система, которая имеет большее количество возможных микросостояний, более дезупорядоченная (более высокая энтропия), чем упорядоченная система (более низкая энтропия) с меньшим количеством микросостояний. Для процессов, включающих увеличение числа микросостояний, WF > Wi, энтропический характер системы увеличивается и ΔS > 0. И наоборот, процессы, сокращающие количество микросостояний, WF < Wi, дают снижение энтропии системы, ΔS < 0.
Рассмотрим распределение идеального газа между двумя подключенными фланками. Изначально молекулы газа ограничены лишь одним из двух флязков. Открытие клапана между створками увеличивает объем, доступный молекулам газа (энергия рассеивается через большую область) и, соответственно, количество микросостояний, возможных для системы. Поскольку WF > Wi, процесс расширения включает увеличение энтропии (ΔS > 0) и является спонтанным.
Аналогичный подход может использоваться для описания спонтанного потока тепла. Чашка горячего чая равномерно распределяет энергию по большему количеству частиц воздуха в помещении с более низкой температурой, что приводит к большему количеству микросостояний.
Обобщений, касающихся энтропии
Отношения между энтропией, микросостояниями и диспергированием материи/энергии позволяют делать обобщения относительно относительных энтропий веществ и предсказывать признаки изменений энтропии для химических и физических процессов.
В твердой фазе атомы или молекулы ограничены почти фиксированными позициями относительно друг друга и способны лишь умеренные колебания относительно этих позиций. Таким образом, количество микросостояний относительно невелико. В жидкой фазе атомы или молекулы свободно перемещаются друг по другу, хотя они остаются в относительно близкой близости друг к другу. Таким образом, количество микросостояний соответственно больше, чем для твердого тела. В результате Sliquid > Ssolid и процесс преобразования вещества из твердого в жидкое (плавление) характеризуется увеличением энтропии, ΔS > 0. По той же логике обратный процесс (замораживание) показывает снижение энтропии, ΔS < 0.
В газовой фазе определенное количество атомов или молекул занимают гораздо больший объем, чем жидкая фаза, что соответствует гораздо большему числу микросостояний. Следовательно, для любого вещества, SGAs > Sliquid > Ssolid и процессы испарения и сублимации также включают увеличение энтропии, ΔS > 0. Аналогично, обратные фазовые переходы – конденсация и осаждение – предполагают снижение энтропии, ΔS < 0.
Согласно кинето-молекулярной теории, температура вещества пропорциональна средней кинетической энергии его частиц. Повышение температуры вещества приведет к более сильной вибрации частиц в твердых телах и более быстрому переводу частиц в жидкости и газы. При более высоких температурах распределение кинетических энергий между атомами или молекулами вещества также более распределено, чем при более низких температурах. Таким образом, энтропия любого вещества увеличивается с температурой.
На энтропию вещества влияет структура частиц (атомов или молекул), составляющих вещество. Что касается атомных веществ, то более тяжелые атомы обладают большей энтропией при заданной температуре, чем более легкие атомы, что является следствием соотношения массы частицы и интервала квантифицированных уровней поступательной энергии. Для молекул большее количество атомов увеличивает количество способов вибрации молекул и, таким образом, количество возможных микросостояний и энтропии системы.
Наконец, вариации типов частиц влияют на энтропию системы. По сравнению с чистым веществом, в котором все частицы идентичны, энтропия смеси двух или более разных типов частиц больше. Это связано с дополнительными ориентациями и взаимодействиями, которые возможны в системе, состоящей из неидентичных компонентов. Например, когда твердое тело растворяется в жидкости, частицы твердого тела испытывают большую свободу движения и дополнительные взаимодействия с частицами растворителя. Это соответствует более равномерному рассеиванию вещества и энергии и большему числу микросостояний. Таким образом, процесс распада предполагает увеличение энтропии, ΔS > 0.
Этот текст адаптирован из Openstax, Химия 2е изд., Глава 16.2: Энтропия.
