17.9:
비표준 상태에서의 자유에너지 변화
17.9:
비표준 상태에서의 자유에너지 변화
비표준 조건(1bar 이외의 압력, 1M 이외의 농도)에 존재하는 반응제 및 제품과 함께 일어나는 공정에 대한 무료 에너지 변화는 이 방정식에 따른 표준 자유 에너지 변화와 관련이 있습니다.
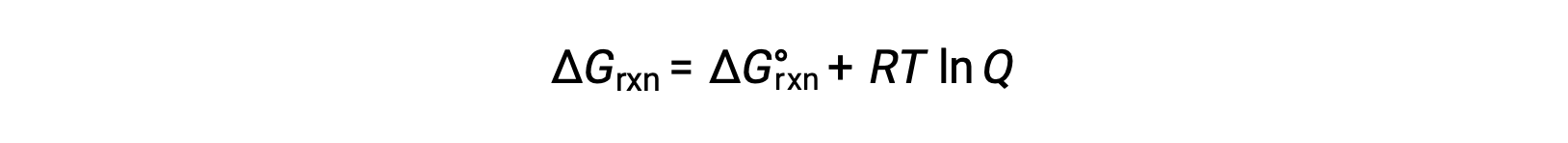
여기서 R은 가스 상수(8.314 J/K·몰), T는 켈빈의 절대 온도이고 Q는 반응 지수이다. 이 방정식은 주어진 조건 집합에서 프로세스의 자발성을 예측하는 데 사용될 수 있습니다.
반응 지수(Q)
가역반응의 상태는 반응 지수Q를평가하여 편리하게 평가된다. 에 의해 설명된 뒤집을 수 있는 반응의 경우
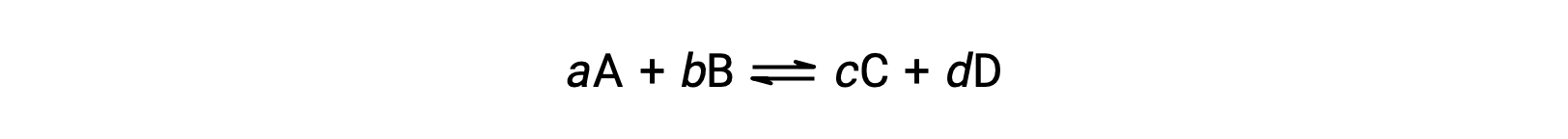
반응 지수는 균형 방정식의 stoichiometry에서 직접 파생됩니다.
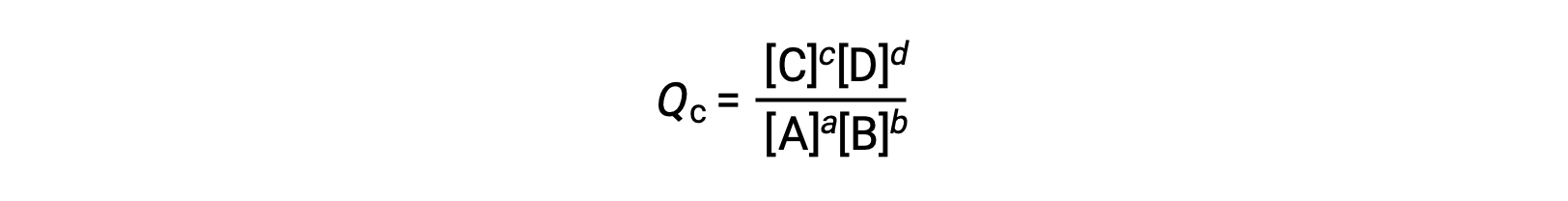
여기서 하위 스크립트 c는 표현식에서 어금니 농도의 사용을 나타낸다. 농도 계 반응 지수, Qc는응축된 위상 평형증에 사용된다. 반응제와 제품이 기체인 경우, 반응 지수가 부분 압력을 사용하여 유사하게 도출될 수 있습니다.
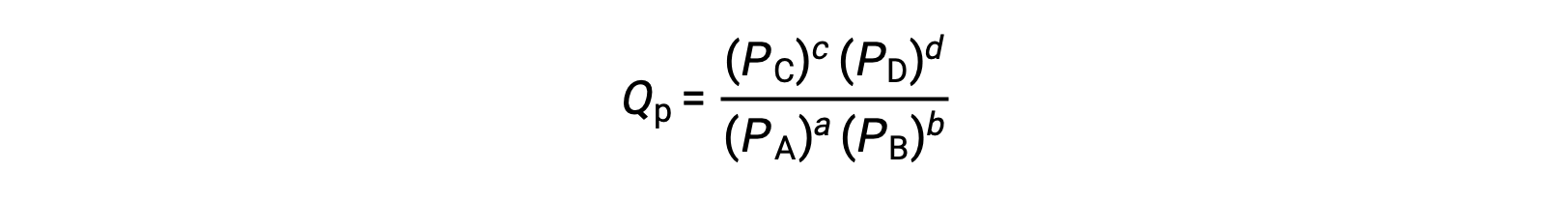
표준 조건에서, 반응제 및 제품 용액 농도는 1M이거나 가스의 압력은 1bar이며 Q는 1과 같습니다. 따라서 표준 조건하에서
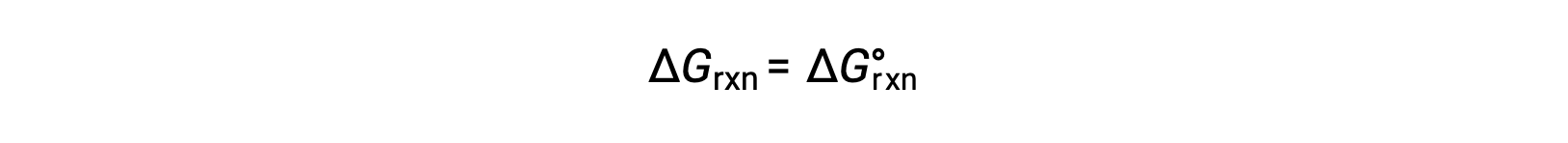
비표준 조건에서 Q를 계산해야 합니다.
Q의 수치 값은 반응이 평형을 향해 진행됨에 따라 다릅니다. 따라서 반응 상태를 나타내는 유용한 지표로 작용할 수 있습니다. 이 점을 설명하기 위해 이산화황의 산화를 고려하십시오.
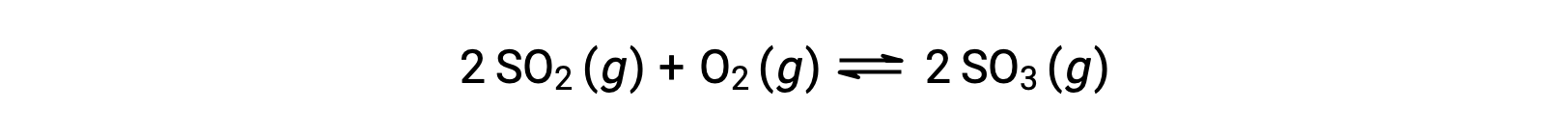
이 반응은 반응제의 혼합물로 만 시작되는 두 가지 실험 시나리오를 고려, SO2 및 O2,그리고 다른 하나는 단지 제품으로 시작, SO3. 반응의 혼합물로만 시작되는 반응의 경우 Q는 처음에는 0과 같습니다.
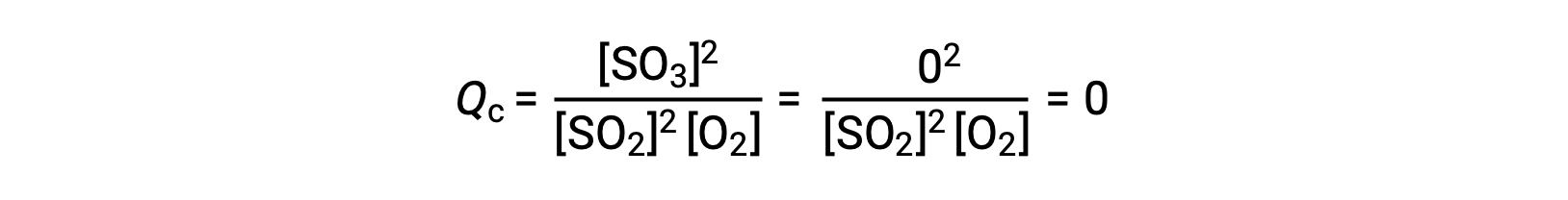
반응이 전방 방향으로 평형을 향해 진행됨에 따라, 반응 농도가 감소(Qc의분모와 마찬가지로), 제품 농도가 증가(Q c의분자와 마찬가지로), 반응 지수가 결과적으로 증가한다. 평형이 달성되면,반응제와 제품의 농도는 Qc의값과 마찬가지로 일정하게 유지됩니다.
반응이 존재하는 제품만으로 시작하는 경우 Qc의 값은 처음에는 정의되지 않았습니다(헤아릴 수 없을 정도로 크거나 무한).
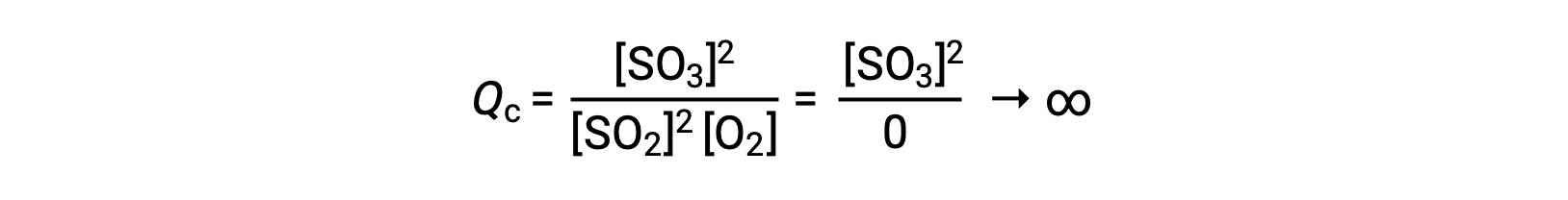
이 경우, 반응은 역방향의 평형으로 진행됩니다. Qc의 제품 농도 및 분자는 시간에 따라 감소하고, 반응 농도 및 Q c의 분모가 증가하고, 평형에서 일정해질 때까지 반응 지수가 감소합니다.
이 텍스트는 오픈 탁스, 화학 2e, 장 16.4에서 적응: 무료 에너지 및 오픈 세금, 화학 2e, 장 13.2: 평형 상수.
