17.9:
Standart Olmayan Durumlar için Serbest Enerji Değişimleri
17.9:
Standart Olmayan Durumlar için Serbest Enerji Değişimleri
Reaktanlarla ve standart olmayan koşullar altında bulunan ürünlerle (1 bar dışındaki basınçlar; 1 M dışındaki konsantrasyonlar) gerçekleşen bir işlem için serbest enerji değişimi, bu denkleme göre standart serbest enerji değişimi ile ilgilidir:
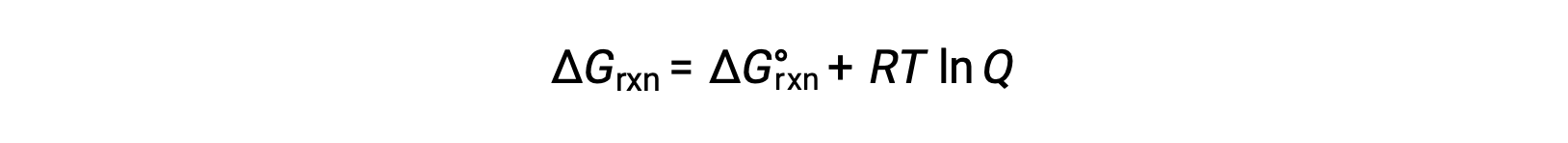
burada R gaz sabitidir (8.314 J/K·mol), T kelvin’deki mutlak sıcaklıktır ve Q reaksiyon katsayısıdır. Bu denklem, herhangi bir koşul seti altında bir işlemin spontanitesini tahmin etmek için kullanılabilir.
Reaksiyon Katsayısı (Q)
Tersinir bir reaksiyonun durumu, reaksiyon katsayısı, Q incelenerek uygun şekilde değerlendirilir. Tersinir bir reaksiyon için bu şekilde tarif edilir
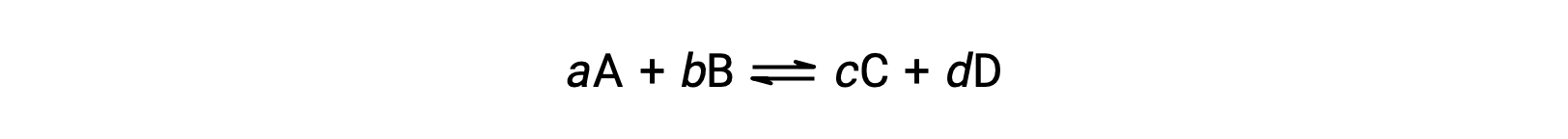
reaksiyon katsayısı doğrudan dengeli denklemin stokiyometrisinden elde edilir
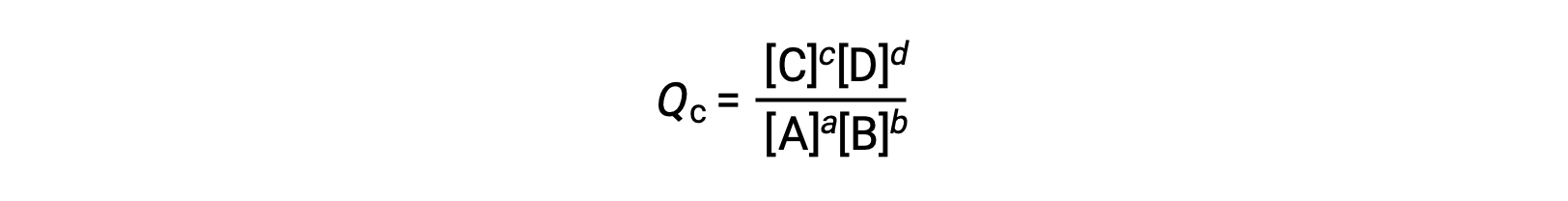
burada alt simge c, ifadede molar konsantrasyonların kullanımını gösterir. Konsantrasyona dayalı reaksiyon katsayısı, Qc, yoğunlaştırılmış faz dengesi için kullanılır. Reaktifler ve ürünler gaz halinde ise, kısmi basınçlar kullanılarak bir reaksiyon katsayısı benzer şekilde türetilebilir:
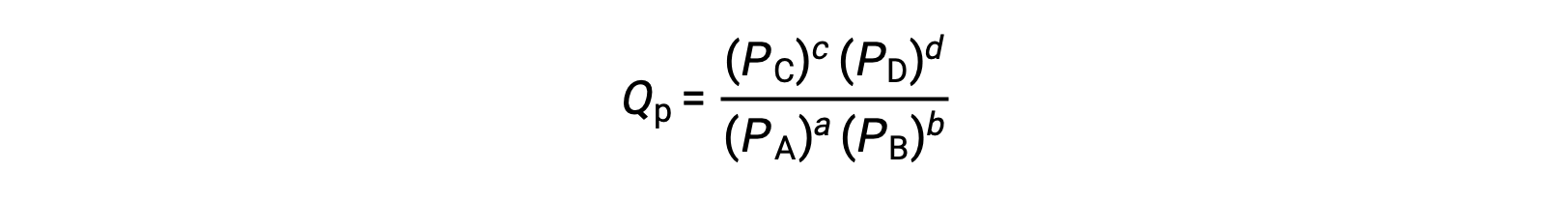
Standart koşullar altında, reaktan ve ürün çözeltisi konsantrasyonları 1 M’dir veya gazların basıncı 1 bar’dır ve Q 1’e eşittir. Bu nedenle, standart koşullar altında
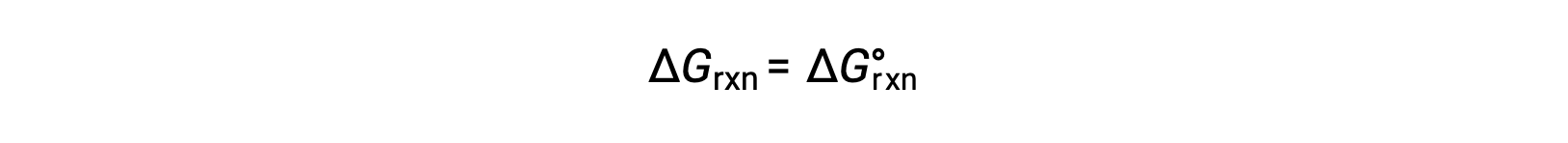
Standart olmayan koşullar altında, Q hesaplanmalıdır.
Q‘nun sayısal değeri, bir reaksiyon dengeye doğru ilerledikçe değişir; bu nedenle, reaksiyonun durumunun yararlı bir göstergesi olarak hizmet edebilir. Bu noktayı göstermek için kükürt dioksitin oksidasyonunu göz önünde bulundurun:
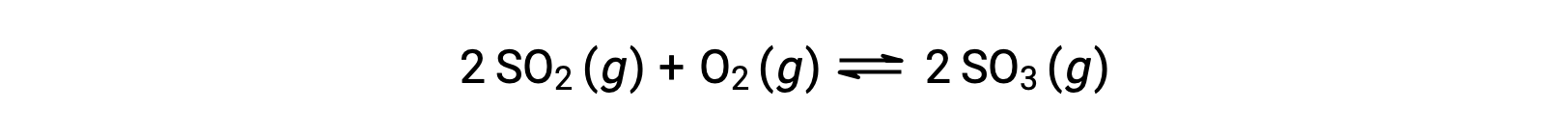
Bu reaksiyonun sadece SO2 ve O2 reaktanlarının bir karışımı ile başlatıldığı ve diğerinin sadece SO3 ürünü ile başladığı iki farklı deneysel senaryo düşünün. Sadece reaktanların bir karışımı ile başlayan reaksiyon için, Q başlangıçta sıfıra eşittir:
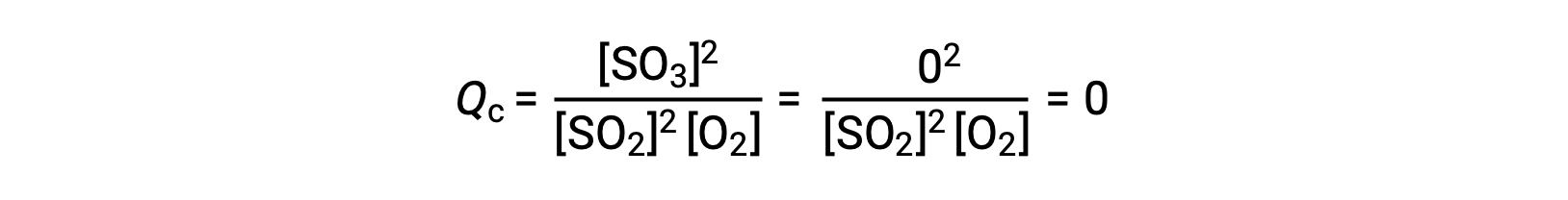
Reaksiyon ileri yönde dengeye doğru ilerledikçe, reaktan konsantrasyonları azalır (Qc‘nin paydası gibi), ürün konsantrasyonu artar (Qc‘nin payında olduğu gibi) ve sonuç olarak reaksiyon katsayısı artar. Denge sağlandığında, reaktanların ve ürünlerin konsantrasyonları, Qc‘nin değeri gibi sabit kalır.
Reaksiyon sadece mevcut ürünle başlarsa, Qc değeri başlangıçta tanımlanmamıştır (ölçülemez derecede büyük veya sonsuz):
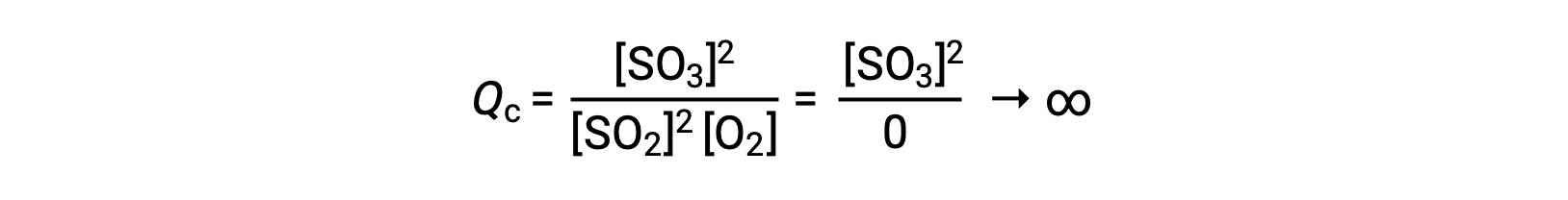
Bu durumda, reaksiyon ters yönde dengeye doğru ilerler. Ürün konsantrasyonu ve Qc payları zamanla azalır, reaktan konsantrasyonları ve Qc paydası artar ve sonuç olarak reaksiyon katsayısı dengede sabit hale gelene kadar azalır.
Bu metin bu kaynaklardan uyarlanmıştır: Openstax, Chemistry 2e, Chapter 16.4: Free Energy ve Openstax, Chemistry 2e, Chapter 13.2: Equilibrium Constants.
