17.9:
Cambiamenti liberi di energia per condizioni non standard
17.9:
Cambiamenti liberi di energia per condizioni non standard
Il cambiamento di energia libera per un processo in corso con reagenti e prodotti presenti in condizioni non standard (pressioni diverse da 1 bar; concentrazioni diverse da 1 M) è correlato al cambiamento di energia libera standard secondo questa equazione:
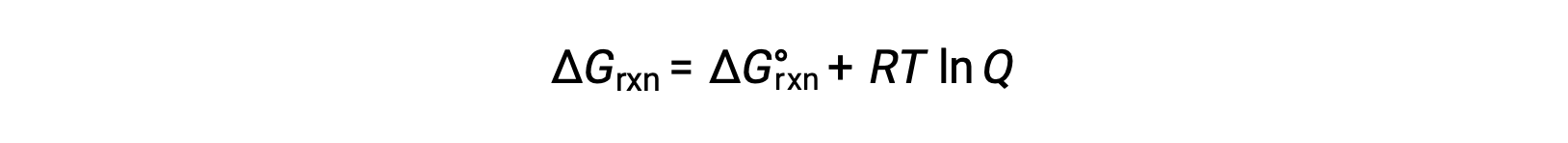
dove R è la costante di gas (8,314 J/K·mol), T è la temperatura assoluta in kelvin, e Q è il quoziente di reazione. Questa equazione può essere usata per prevedere la spontaneità di un processo in un dato insieme di condizioni.
Quoziente di reazione (Q)
Lo stato di una reazione reversibile è convenientemente valutato valutando il suo quoziente di reazione, Q. Per una reazione reversibile descritta da
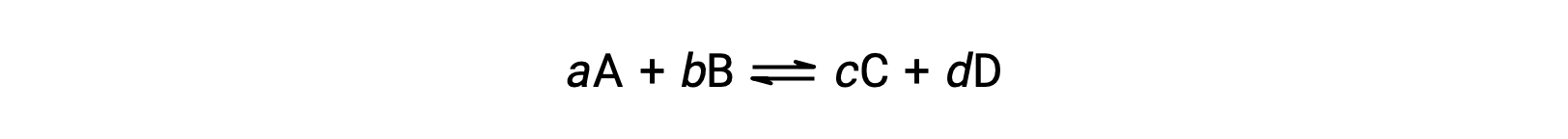
il quoziente di reazione è derivato direttamente dalla stechiometria dell’equazione bilanciata come
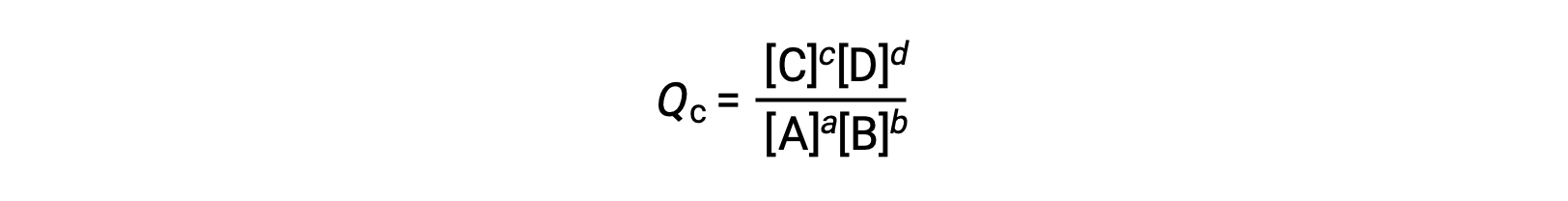
dove il pedice c denota l’uso di concentrazioni molare nell’espressione. Il quoziente di reazione basato sulla concentrazione, Qc, è usato per gli equilibri di fase condensati. Se i reagenti e i prodotti sono gassosi, un quoziente di reazione può essere derivato in modo simile utilizzando pressioni parziali:
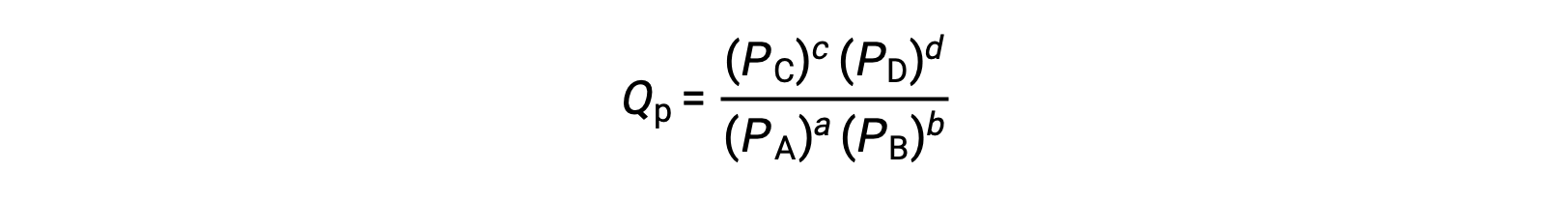
In condizioni standard, le concentrazioni di reagente e soluzione del prodotto sono 1 M, o la pressione dei gas è di 1 bar, e Q è uguale a 1. Pertanto, in condizioni standard
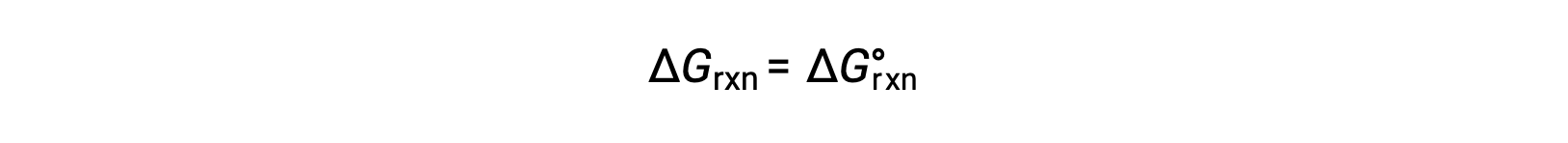
In condizioni non standard, Q deve essere calcolato.
Il valore numerico di Q varia man mano che una reazione procede verso l’equilibrio; pertanto, può servire come indicatore utile dello stato della reazione. Per illustrare questo punto, considera l’ossidazione dell’anidride solforosa:
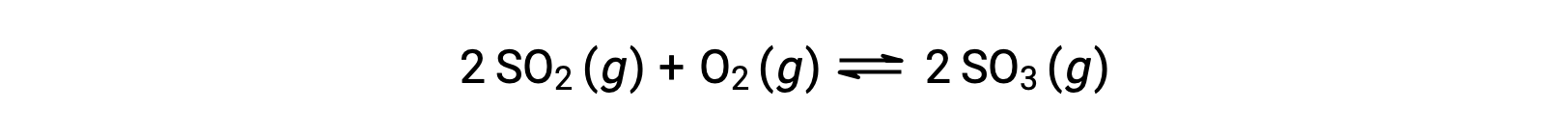
Si consideri due diversi scenari sperimentali, uno in cui questa reazione viene iniziata solo con una miscela di reagenti, SO2 e O2, e un altro che inizia solo con il prodotto, SO3. Per la reazione che inizia solo con una miscela di reagenti, Q è inizialmente uguale a zero:
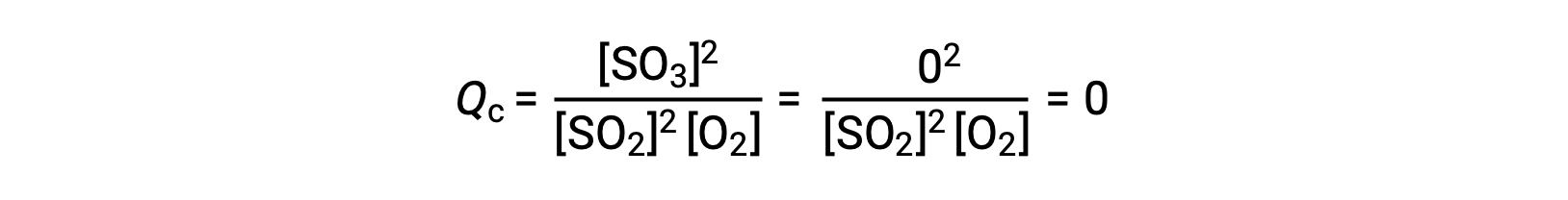
Man mano che la reazione procede verso l’equilibrio nella direzione in avanti, le concentrazioni reagenti diminuiscono (così come il denominatore di Qc), la concentrazione del prodotto aumenta (così come il numeratore di Qc), e il quoziente di reazione aumenta di conseguenza. Quando si raggiunge l’equilibrio, le concentrazioni di reagenti e prodotti rimangono costanti, così come il valore di Qc.
Se la reazione inizia solo con il prodotto presente, il valore di Qc è inizialmente indefinito (incommensurabilmente grande o infinito):
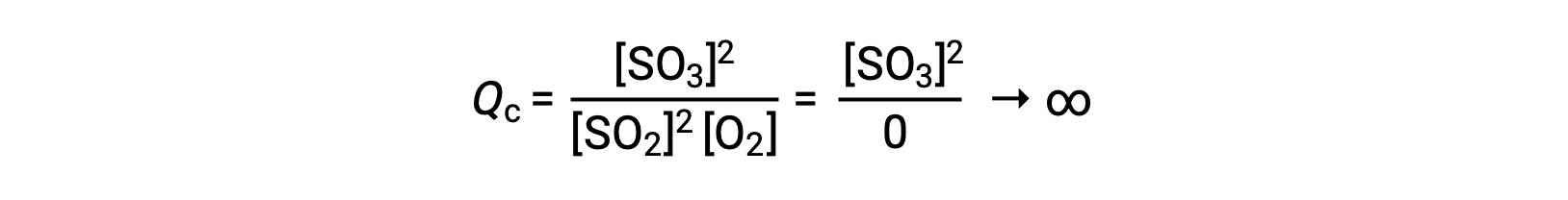
In questo caso, la reazione procede verso l’equilibrio nella direzione inversa. La concentrazione del prodotto e il numeratore di Qc diminuiscono con il tempo, le concentrazioni reagenti e il denominatore di Qc aumentano, e il quoziente di reazione diminuisce di conseguenza fino a diventare costante all’equilibrio.
Questo testo è adattato da Openstax, Chimica 2e, Capitolo 16.4: Energia Libera e Openstax, Chimica 2e, Capitolo 13.2: Costanti di equilibrio.
