18.1:
Balanceo de Ecuaciones Redox
18.1:
Balanceo de Ecuaciones Redox
La electroquímica es la ciencia involucrada en la interconversión de reacciones eléctricas y químicas. Tales reacciones se llaman de reducción-oxidación, o reacciones redox. Estas importantes reacciones se definen por cambios en los estados de oxidación para uno o más elementos reactantes e incluyen un subconjunto de reacciones que implican la transferencia de electrones entre especies reactantes. La electroquímica como campo ha evolucionado para ofrecer suficientes conocimientos sobre los principios fundamentales de la química redox y múltiples tecnologías que van desde procesos metalúrgicos a escala industrial hasta baterías recargables y robustas para vehículos eléctricos. Como las reacciones que involucran la transferencia de electrones son esenciales para el estudio de la electroquímica, una breve revisión de la química redox incluye lo siguiente.
Números de oxidación
Por definición, una reacción redox implica un cambio en el número de oxidación o en el estado de oxidación de uno o varios reactivos. El número de oxidación de un elemento es una evaluación de cómo el entorno electrónico de sus átomos difiere en comparación con los átomos del elemento puro. Por esta definición, un átomo en un elemento lleva un número de oxidación de cero. Para un átomo, el número de oxidación es igual a la carga del átomo en el compuesto si el compuesto era iónico. Así, la suma de los números de oxidación para todos los átomos de una molécula es igual a la carga de la molécula.
Compuestos iónicos
Los compuestos iónicos simples son los ejemplos más sencillos de este formalismo ya que los elementos tienen números de oxidación iguales a sus cargas iónicas. El cloruro de sodio, NaCl, está compuesto por cationes Na+ y aniones Cl−, siendo los números de oxidación para el sodio y el cloro +1 y −1, respectivamente. El fluoruro de calcio, CaF2, se compone de cationes Ca2+ cationes y aniones F−, con números de oxidación para calcio y flúor, +2, y −1 respectivamente.
Compuestos covalentes
Los compuestos covalentes son más desafiantes en el uso del formalismo. El agua es un compuesto covalente que consta de dos átomos de H unidos a un átomo de O a través de enlaces covalentes polares O−H. Los electrones compartidos que forman un enlace O−H son más atraídos al átomo O más electronegativo. Por lo tanto, el oxígeno adquiere una carga negativa parcial, en comparación con un átomo de O en el oxígeno elemental. Como resultado, los átomos de H de una molécula de agua presentan una carga positiva parcial en comparación con los átomos de hidrógeno del gas hidrógeno. La suma de las cargas parciales negativas y positivas para cada molécula de agua es cero, lo que hace que la molécula de agua sea neutra.
Si la polarización de los electrones compartidos dentro de los enlaces O−H del agua estuviera completa, el resultado sería la transferencia completa de electrones de H a O, y el agua sería un compuesto iónico formado por aniones O2− y cationes H+. Y así, los números de oxidación para el oxígeno y el hidrógeno en agua son −2 y +1, respectivamente. Al aplicar esta misma lógica al tetracloruro de carbono, CCl4, se obtienen números de oxidación de +4 para el carbono y −1 para el cloro. En el ion nitrato, NO3−, el número de oxidación para el nitrógeno es +5 y el del oxígeno es −2, sumando para igualar la carga −1 sobre la molécula:
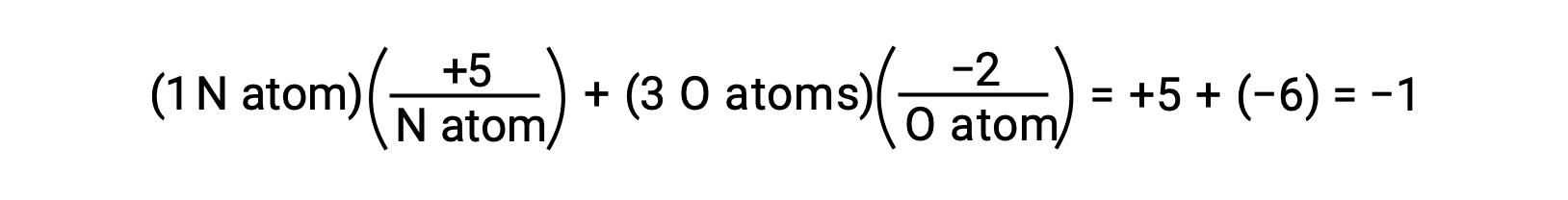
Balanceando ecuaciones redox
La ecuación no balanceada que se muestra a continuación describe la descomposición del cloruro de sodio:
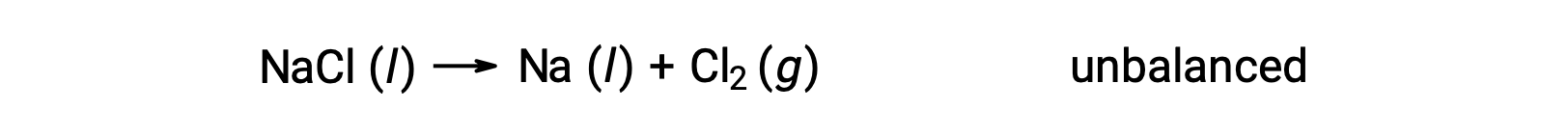
Esta reacción coincide con el criterio de una reacción redox, ya que el número de oxidación para el Na disminuye de +1 a 0 (por reducción) y el del Cl aumenta de −1 a 0 (por oxidación). El caso de la ecuación se balancea fácilmente añadiendo el coeficiente estequiométrico 2 para el NaCl y el Na:
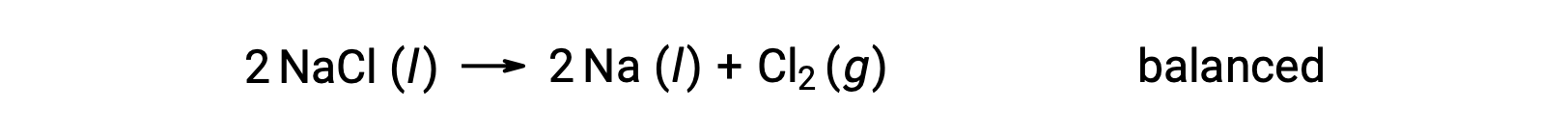
Las reacciones redox que ocurren en soluciones acuosas son comúnes en electroquímica, y muchas involucran agua o sus iones, H+ (ac) y OH− (ac), ya sea como reactivos o productos.
En estos casos, las ecuaciones que representan reacciones redox pueden ser muy difíciles de balancear simplemente por inspección, y el uso de un enfoque sistemático conocido como método de la semirreacción es útil. Este enfoque implica los siguientes pasos:
- Divida la ecuación en las semirreacciones de oxidación y reducción del esqueleto que la compone.
- Balancee cada semirreacción para todos los elementos que no sean O y H.
- Balancee cada semirreacción para los átomos de O agregando moléculas de agua según sea necesario en la ecuación.
- Equilibre cada semirreacción para los átomos de H agregando protones según sea necesario para la ecuación.
- Finalmente, balancee las cargas en los elementos agregando electrones según sea necesario.
- Multiplique las semirreacciones por cualquier entero necesario para igualar el número de electrones perdidos en la semirreacción de oxidación al número de electrones ganados en la semirreacción de reducción.
- Sume ambas semirreacciones y simplifique aún más cancelando especies comunes en ambos lados de la ecuación.
- Si la reacción se produce en un medio alcalino, añada iones OH− a la ecuación obtenida en el paso 7 para neutralizar los protones (añadidos en números iguales a ambos lados de la ecuación) y simplifique.
- Compruebe la ecuación para asegurarse de que las cargas en los átomos están balanceadas.
Este texto está adaptado de Openstax, Química 2e, Capítulo 17: Introducción, y Openstax, Química 2e, Section17.2: Revisión de la Química Redox.
