19.3:
Stabilità nucleare
19.3:
Stabilità nucleare
Protoni e neutroni, collettivamente chiamati nucleoni, sono impacchettato strettamente in un nucleo. Con un raggio di circa 10−15 metri, un nucleo è piuttosto piccolo rispetto al raggio dell’intero atomo, che è di circa 10−10 metri. I nuclei sono estremamente densi rispetto alla materia sfusa, con una media di 1,8 × 1014 grammi per centimetro cubo. Se la densità terrestre fosse uguale alla densità nucleare media, il raggio terrestre sarebbe solo di circa 200 metri.
Tenere insieme protoni carichi positivamente nel piccolissimo volume di un nucleo richiede forze attrattive molto forti perché i protoni caricati positivamente si respingono fortemente a distanze così brevi. La forza di attrazione che tiene insieme il nucleo è la forte forza nucleare. Questa forza agisce tra protoni, tra neutroni e tra protoni e neutroni. È molto diverso dalla forza elettrostatica che mantiene elettroni caricati negativamente attorno a un nucleo caricato positivamente. Su distanze inferiori a 10−15 metri e all’interno del nucleo, la forza nucleare forte è molto più forte delle repulsioni elettrostatiche tra protoni; su distanze maggiori e al di fuori del nucleo, è essenzialmente inesistente.
Un grafico del numero di neutroni rispetto al numero di protoni per nuclei stabili rivela che gli isotopi stabili cadono in una banda stretta. Questa regione è conosciuta come la banda di stabilità (chiamata anche cintura, zona o valle di stabilità). La linea retta nella figura 1 rappresenta nuclei che hanno un rapporto 1:1 tra protoni e neutroni (rapporto n:p). Si noti che i nuclei stabili più leggeri, in generale, hanno lo stesso numero di protoni e neutroni. Ad esempio, l’azoto-14 ha sette protoni e sette neutroni. I nuclei stabili più pesanti, tuttavia, hanno sempre più neutroni che protoni. Ad esempio: il nuclide stabile ferro-56 ha 30 neutroni e 26 protoni, un rapporto n:p di 1,15, mentre il piombo nuclide stabile-207 ha 125 neutroni e 82 protoni, un rapporto n:p pari a 1,52. Questo perché i nuclei più grandi hanno più repulsioni protone-protone e richiedono un maggior numero di neutroni per fornire forze forti compensative per superare queste repulsioni elettrostatiche e tenere insieme il nucleo.
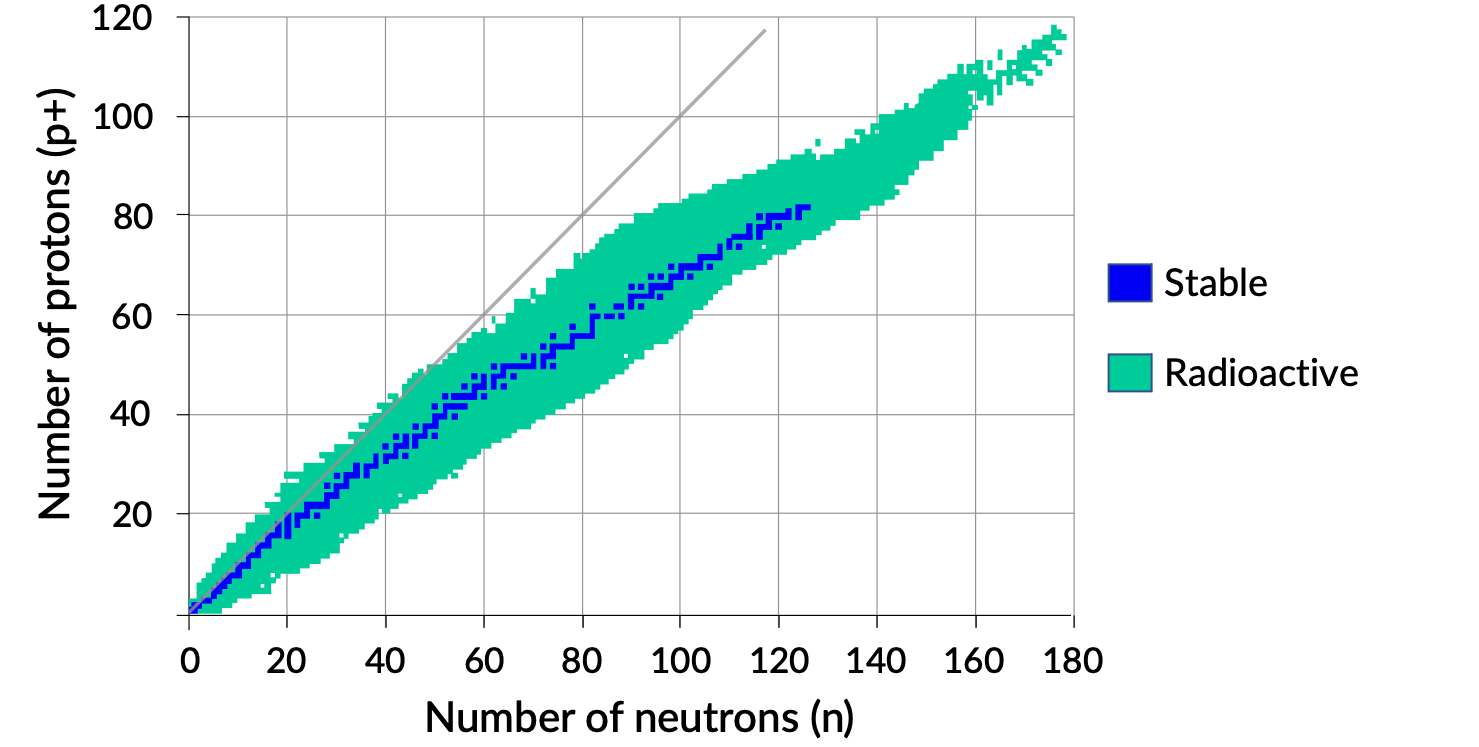
Figura 1. Fascia di stabilità.
I nuclei al di fuori della banda di stabilità sono instabili e mostrano radioattività: cambiano spontaneamente, o decadimento, in altri nuclei che sono all’interno o più vicini alla banda di stabilità. Queste reazioni di decadimento nucleare convertono un nuclide instabile, o radionuclide, in un altro nuclide, che è spesso più stabile.
Si possono fare diverse osservazioni sulla relazione tra la stabilità di un nucleo e la sua struttura.
I nuclei con un numero pari di protoni, neutroni o entrambi hanno maggiori probabilità di essere stabili. I nuclei con un certo numero di nucleoni, noti come numeri magici, sono stabili contro il decadimento nucleare. Questi numeri di protoni o neutroni (2, 8, 20, 28, 50, 82 e 126) fanno gusci completi nel nucleo. Questi sono simili nel concetto ai gusci di elettroni stabili osservati per i gas nobili. I nuclei che hanno un numero magico di protoni e neutroni sono chiamati “doppiamente magici” e sono particolarmente stabili.
I nuclei con numeri atomici superiori a 82 sono radioattivi. Si pensava che il Bismuto-209, numero atomico 83, fosse stabile per molto tempo e possa essere maneggiato come se non fosse radioattivo. Sebbene sia radioattivo, ha un’emidità eccezionalmente lunga tra i radionuclidi.
Gli isotopi radioattivi presenti in natura degli elementi più pesanti cadono in catene di successive disintegrazioni, o decadimenti, e tutte le specie in una catena costituiscono una famiglia radioattiva, o serie di decadimento radioattivo. Tre di queste serie comprendono la maggior parte degli elementi naturalmente radioattivi della tavola periodica. Sono la serie dell’uranio, la serie dell’attinide e la serie del torio. La serie del nettunio è una quarta serie, che non è più significativa sulla terra a causa delle brevi emimidi delle specie coinvolte.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 21.1: Struttura nucleare e stabilità.
