19.3:
Stabilité nucléaire
19.3:
Stabilité nucléaire
Les protons et les neutrons, qui collectivement sont appelés nucléons, sont étroitement regroupés dans un noyau. Avec un rayon d’environ 10−15 mètres, un noyau est plutôt petit par rapport au rayon de l’atome entier, qui est d’environ 10−10 mètres. Les noyaux sont extrêmement denses par rapport à la majeure partie de la matière, avec une moyenne de 1,8 × 1014 grammes par centimètre cube. Si la densité de la terre était égale à la densité nucléaire moyenne, le rayon de la terre serait d’environ 200 mètres seulement.
Maintenir ensemble des protons chargés positivement dans le très petit volume du noyau nécessite des forces d’attraction très intenses car les protons chargés positivement se repoussent fortement les uns les autres à des distances aussi courtes. La force d’attraction qui maintient le noyau ensemble est l’intense force nucléaire. Cette force agit entre les protons, entre les neutrons et entre les protons et les neutrons. Elle est très différente de la force électrostatique qui maintient les électrons chargés négativement autour d’un noyau chargé positivement. Sur des distances inférieures à 10−15 mètres et à l’intérieur du noyau, la force nucléaire est beaucoup plus intense que les répulsions électrostatiques entre les protons ; sur de plus grandes distances et à l’extérieur du noyau, elle est essentiellement inexistante.
Un tracé du nombre de neutrons par rapport au nombre de protons pour les noyaux stables révèle que les isotopes stables se situent dans une bande étroite. Cette région est connue sous le nom de bande de stabilité (également appelée la ceinture, zone ou vallée de stabilité). La ligne droite de la figure 1 représente les noyaux qui ont un rapport de protons aux neutrons (rapport n/p) de 1/1. Notez que les noyaux stables plus légers ont en général un nombre égal de protons et de neutrons. Par exemple, l’azote 14 a sept protons et sept neutrons. Toutefois, les noyaux stables plus lourds ont, de façon croissante, plus de neutrons que de protons. Par exemple : le nucléide stable fer 56 a 30 neutrons et 26 protons ainsi qu’un rapport n:p de 1,15 alors que le nucléide stable plomb 207 a 125 neutrons et 82 protons, soit un rapport n:p égal à 1,52. Cela est dû au fait que les noyaux de plus grande taille ont plus de répulsions proton–proton, et ils ont besoin de plus grands nombres de neutrons pour fournir des forces de compensation intenses afin de surmonter ces répulsions électrostatiques et maintenir le noyau ensemble.
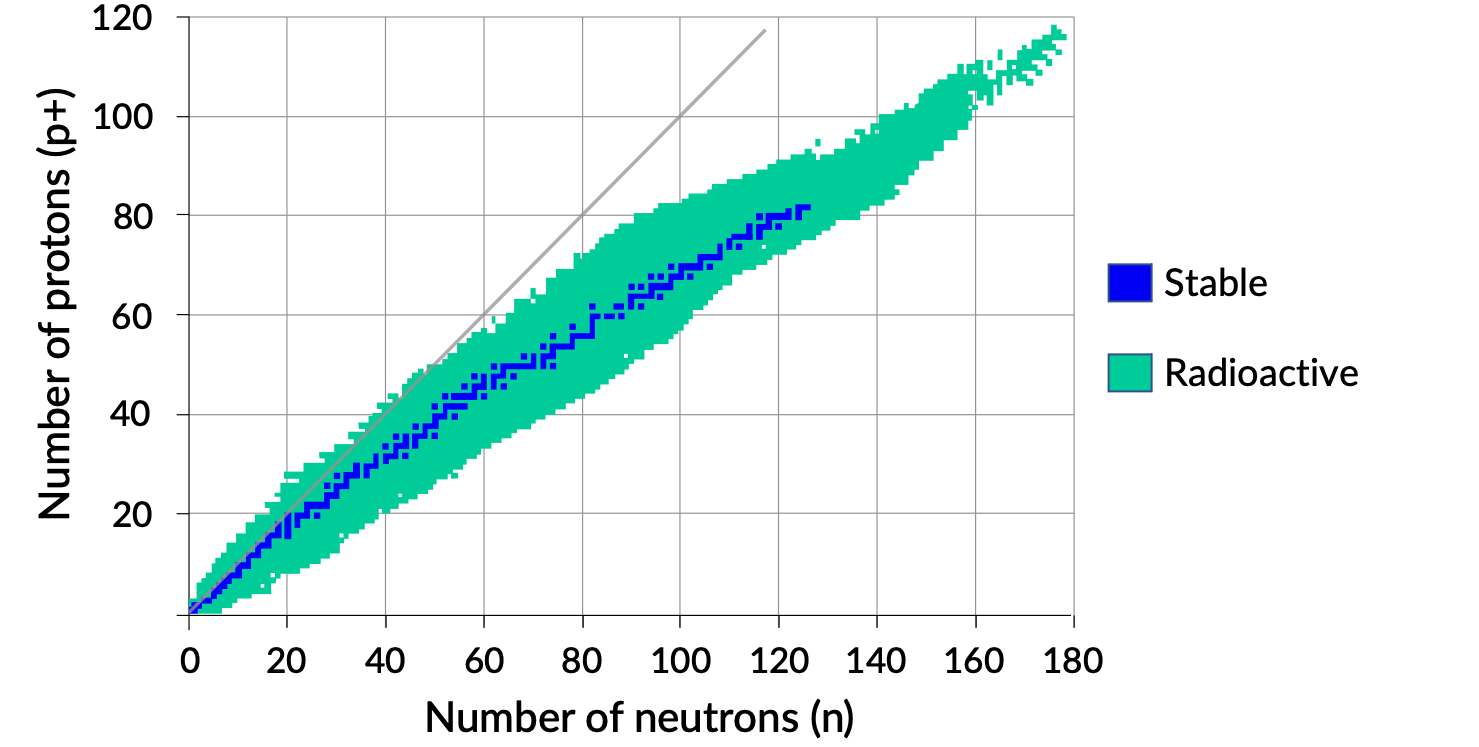
Figure 1. Bande de stabilité.
Les noyaux situés en dehors de la bande de stabilité sont instables et présentent une radioactivité : ils se transforment spontanément, ou se désintègrent, en d’autres noyaux qui se trouvent soit dans la bande de stabilité, soit plus près de celle-ci. Ces réactions de désintégration nucléaire transforment un nucléide instable, ou radionucléide, en un autre nucléide, qui est souvent plus stable.
Plusieurs observations peuvent être faites en ce qui concerne la relation entre la stabilité d’un noyau et sa structure.
Les noyaux avec des nombres pairs de protons, de neutrons ou des deux sont plus susceptibles d’être stables. Les noyaux avec certains nombres de nucléons, connus sous le nom de nombres magiques, sont stables par rapport à la désintégration nucléaire. Ces nombres de protons ou de neutrons (2, 8, 20, 28, 50, 82, et 126) font des couches complètes dans le noyau. Leur concept est semblable aux couches électroniques stables observées dans le cas des gaz nobles. Les noyaux qui ont des nombres magiques de protons et de neutrons sont dits “ doublement magiques ” et sont particulièrement stables.
Les noyaux dont le nombre atomique est supérieur à 82 sont radioactifs. On pensait que le bismuth 209, numéro atomique 83, était stable pendant une très longue période et qu’il pouvait être manipulé comme s’il était non radioactif. Bien qu’il soit radioactif, il a une demi-vie exceptionnellement longue parmi les radionucléides.
Les isotopes radioactifs naturels des éléments les plus lourds s’effondre en chaînes de désintégrations successives, ou décroissance, et toutes les espèces d’une même chaîne constituent une famille radioactive, ou une série de désintégrations radioactives. Trois de ces séries comprennent la plupart des éléments naturellement radioactifs du tableau périodique. Il s’agit de la série de l’uranium, de la série de l’actinide et de la série du thorium. La série neptunium est une quatrième série, qui n’est plus significative sur la terre en raison de la courte demi-vie des espèces impliquées.
Ce texte est adapté de Openstax, Chimie 2e, Section 21.1 : Structure et stabilité nucléaires.
