19.3:
Estabilidad Nuclear
19.3:
Estabilidad Nuclear
Los protones y los neutrones, llamados colectivamente nucleones, se empaquetan firmemente en un núcleo. Con un radio de unos 10−15 metros, un núcleo es bastante pequeño comparado con el radio de todo el átomo, que es de unos 10−10 metros. Los núcleos son extremadamente densos en comparación con la materia a granel, con un promedio de 1,8 × 1014 gramos por centímetro cúbico. Si la densidad de la tierra fuera igual a la densidad nuclear media, el radio de la tierra sería de sólo unos 200 metros.
Para mantener juntos a los protones cargados positivamente en el pequeño volumen de un núcleo se requieren fuerzas de atracción muy fuertes porque los protones cargados positivamente se repelen fuertemente a distancias tan cortas. La fuerza de atracción que mantiene unido el núcleo es la gran fuerza nuclear. Esta fuerza actúa entre protones, entre neutrones, y entre protones y neutrones. Es muy diferente de la fuerza electrostática que mantiene electrones cargados negativamente alrededor de un núcleo cargado positivamente. En distancias inferiores a 10−15 metros y dentro del núcleo, la fuerza nuclear es mucho más fuerte que las repulsiones electrostáticas entre protones; en distancias más grandes y fuera del núcleo, es esencialmente inexistente.
Un gráfico del número de neutrones frente al número de protones para núcleos estables revela que los isótopos estables caen en una banda estrecha. Esta región se conoce como la banda de estabilidad (también llamada correa, zona o valle de estabilidad). La línea recta de la Figura 1 representa núcleos que tienen una relación 1:1 de protones a neutrones (relación n:p). Observe que los núcleos estables más ligeros, en general, tienen el mismo número de protones y neutrones. Por ejemplo, el nitrógeno-14 tiene siete protones y siete neutrones. Sin embargo, los núcleos estables más pesados tienen cada vez más neutrones que protones. Por ejemplo: El nucleido estable hierro-56 tiene 30 neutrones y 26 protones, una relación n:p de 1,15, mientras que el nucleido estable plomo-207 tiene 125 neutrones y 82 protones, una relación n:p igual a 1,52. Esto se debe a que los núcleos más grandes tienen más repulsiones protón-protón y requieren un mayor número de neutrones para proporcionar grandes fuerzas compensadoras para superar estas repulsiones electrostáticas y mantener el núcleo unido.
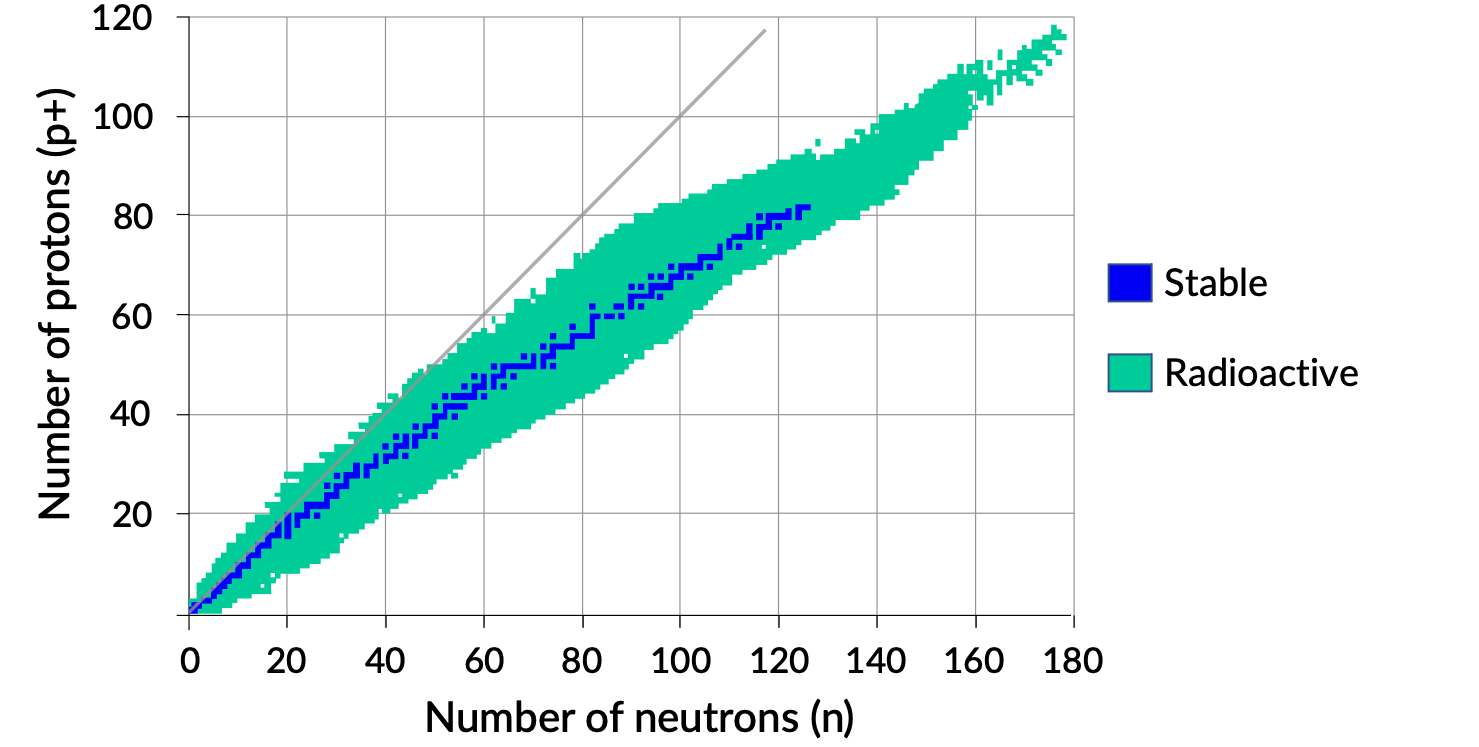
Figura 1. Banda de estabilidad.
Los núcleos fuera de la banda de estabilidad son inestables y exhiben radioactividad: Cambian espontáneamente, o se desintegran, en otros núcleos que están dentro o más cerca de la banda de estabilidad. Estas reacciones de desintegración nuclear convierten un nucleido inestable, o radionucleido, en otro nucleido, que a menudo es más estable.
Se pueden hacer varias observaciones sobre la relación entre la estabilidad de un núcleo y su estructura.
Es más probable que los núcleos con un número uniforme de protones, neutrones o ambos sean estables. Los núcleos con ciertos números de nucleones, conocidos como números mágicos, son estables frente la desintegración nuclear. Estos números de protones o neutrones (2, 8, 20, 28, 50, 82, y 126) hacen capas completas en el núcleo. Estos son similares en concepto a los depósitos de electrones estables observados para los gases nobles. Los núcleos que tienen números mágicos tanto de protones como de neutrones se llaman “doblemente mágicos” y son particularmente estables.
Los núcleos con números atómicos superiores a 82 son radiactivos. Se pensaba que el bismuto-209, número atómico 83, era estable durante mucho tiempo y se podía manejar como si fuera no radiactivo. Aunque es radiactivo, tiene una semivida excepcionalmente larga entre los radionucleidos.
Los isótopos radiactivos que ocurren naturalmente de los elementos más pesados caen en cadenas de desintegraciones sucesivas, o decaen, y todas las especies en una cadena constituyen una familia radiactiva, o series de desintegración radiactiva. Tres de estas series incluyen la mayoría de los elementos naturalmente radiactivos de la tabla periódica. Son la serie del uranio, la serie de los actínidos y la serie del torio. La serie de neptunio es una cuarta serie, que ya no es significativa en la tierra debido a la corta vida media de las especies involucradas.
Este texto ha sido adaptado de Openstax, Química 2e, Sección 21.1: Estructura Nuclear y Estabilidad.
