19.3:
Estabilidade Nuclear
19.3:
Estabilidade Nuclear
Os protões e neutrões, chamados coletivamente de nucleões, estão compactados firmemente em um núcleo. Com um raio de cerca de 10−15 metros, um núcleo é bastante pequeno em comparação com o raio de todo o átomo, que é de cerca de 10−10 metros. Os núcleos são extremamente densos em comparação com a matéria total, com uma média de 1,8 × 1014 gramas por centímetro cúbico. Se a densidade da terra fosse igual à densidade nuclear média, o raio da terra seria de apenas cerca de 200 metros.
Manter os protões carregados positivamente juntos no volume muito pequeno de um núcleo requer forças de atração muito fortes porque os protões carregados positivamente repelem-se fortemente uns aos outros em tais distâncias curtas. A força de atração que mantém o núcleo unido é a força nuclear forte. Esta força actua entre protões, entre neutrões, e entre protões e neutrões. É muito diferente da força eletrostática que mantém eletrões carregados negativamente em torno de um núcleo com carga positiva. A distâncias inferiores a 10−15 metros e dentro do núcleo, a força nuclear forte é muito mais forte do que as repulsões eletrostáticas entre protões; a distâncias maiores e fora do núcleo, é essencialmente inexistente.
Um gráfico do número de neutrões versus o número de protões para núcleos estáveis revela que os isótopos estáveis caem em uma banda estreita. Esta região é conhecida como a faixa de estabilidade (também chamada de cinturão, zona, ou vale de estabilidade). A linha recta na Figura 1 representa núcleos que têm uma relação de 1:1 de protões para neutrões (razão n:p). Note que os núcleos estáveis mais leves, no geral, têm números iguais de protões e neutrões. Por exemplo, o nitrogénio-14 tem sete protões e sete neutrões. Núcleos estáveis mais pesados, no entanto, têm cada vez mais neutrões do que protões. Por exemplo: o nuclídeo estável ferro-56 tem 30 neutrões e 26 protões, uma razão n:p de 1,15, enquanto que o nuclídeo estável chumbo-207 tem 125 neutrões e 82 protões, uma razão n:p igual a 1,52. Isto deve-se ao facto de os núcleos maiores terem mais repulsões protão–protão e exigirem um maior número de neutrões para fornecer forças de compensação fortes para superar estas repulsões eletrostáticas e manter o núcleo unido.
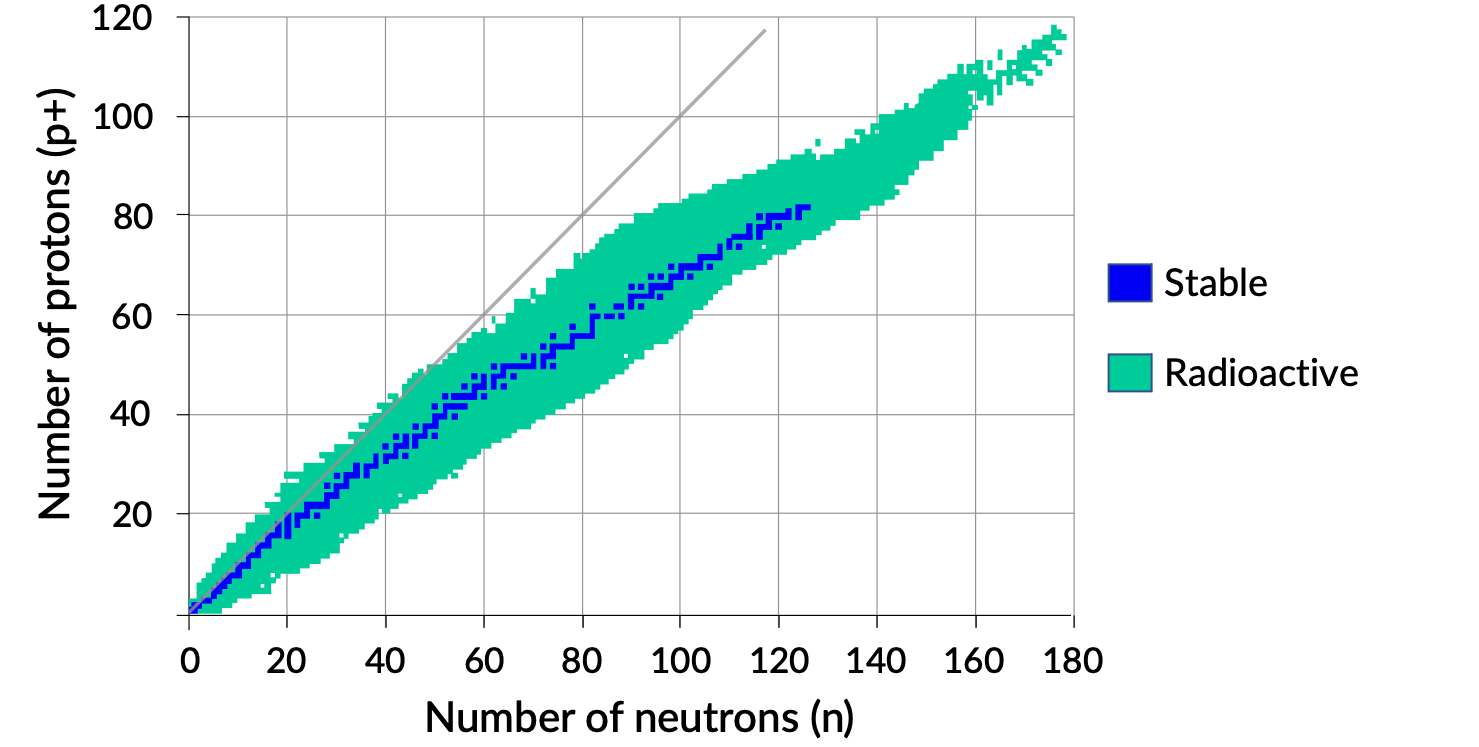
Figura 1. Banda de estabilidade.
Os núcleos fora da faixa de estabilidade são instáveis e apresentam radioatividade: eles mudam espontaneamente, ou decaem, para outros núcleos que estão dentro ou mais próximos da banda de estabilidade. Estas reações de decaimento nuclear convertem um nuclídeo instável, ou radionuclídeo, em um outro nuclídeo, que é frequentemente mais estável.
Podem ser feitas várias observações sobre a relação entre a estabilidade de um núcleo e a sua estrutura.
Os núcleos com números pares de protões, neutrões, ou ambos têm maior probabilidade de serem estáveis. Núcleos com certos números de nucleões, conhecidos como números mágicos, são estáveis contra o decaimento nuclear. Estes números de protões ou neutrões (2, 8, 20, 28, 50, 82, e 126) fazem camadas completas no núcleo. Estes são semelhantes em termos de conceito às camadas estáveis de eletrões observadas para os gases nobres. Os núcleos com números mágicos de protões e neutrões são chamados de “duplamente mágicos” e são particularmente estáveis.
Núcleos com números atómicos superiores a 82 são radioativos. O bismuto-209, número atómico 83, foi considerado estável por muito tempo e pode ser manuseado como se não fosse radioativo. Embora seja radioativo, tem uma meia-vida excepcionalmente longa entre radionuclídeos.
Os isótopos radioativos dos elementos mais pesados que ocorrem naturalmente caem em cadeias de sucessivas desintegrações, ou decaimentos, e todas as espécies em uma cadeia constituem uma família radioativa, ou série de decaimento radioativo. Três dessas séries incluem a maioria dos elementos naturalmente radioativos da tabela periódica. São a série do urânio, a série dos actinídeos, e a série do tório. A série do neptúnio é uma quarta série, que já não é significativa na terra por causa da meia-vida curta das espécies envolvidas.
Este texto é adaptado de Openstax, Chemistry 2e, Section 21.1: Nuclear Structure and Stability.
