9.5:
Decadimento radioattivo e datazione radiometrica
9.5:
Decadimento radioattivo e datazione radiometrica
La radioattività è una disintegrazione spontanea di un nuclide instabile ed è un processo casuale, poiché tutti i nuclei del campione non decadono simultaneamente. Il numero di disintegrazioni per unità di tempo è chiamato attività (A), che è direttamente proporzionale al numero di nuclei nel campione. La costante di decadimento (λ) è una probabilità media di decadimento per nucleo in tempo unitario.
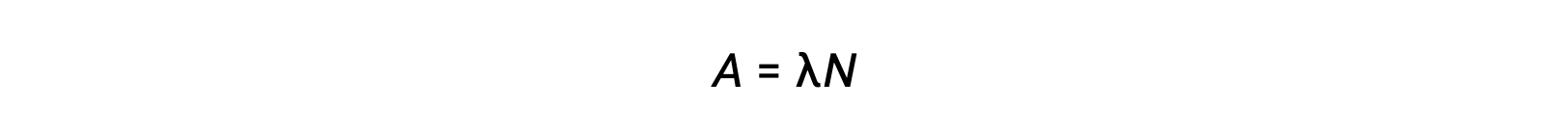
L’unità SI per l’attività è il becquerel, che è una disintegrazione al secondo. Un’altra unità di attività è il curie, che è pari a 37 miliardi di becquerel. L’attività di plottaggio rispetto al tempo per i diversi radionuclidi indica diversi tassi di decadimento. Il tempo necessario affinché l’attività cada da qualsiasi valore alla metà di tale valore è un’emi vitale, indicata come t1/2.
Poiché l’attività è proporzionale al numero di atomi radioattivi, diminuisce con il tempo man mano che la quantità di campione diminuisce. Matematicamente, l’attività di un radionuclide è indicata da un’equazione esponenziale:
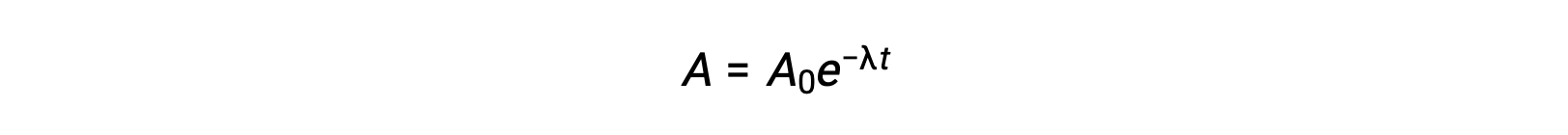
Così, quando l’attività è ridotta a metà, riorganizzare l’equazione fornisce un modo per calcolare l’emidità, che è inversamente proporzionale alla costante di decadimento.
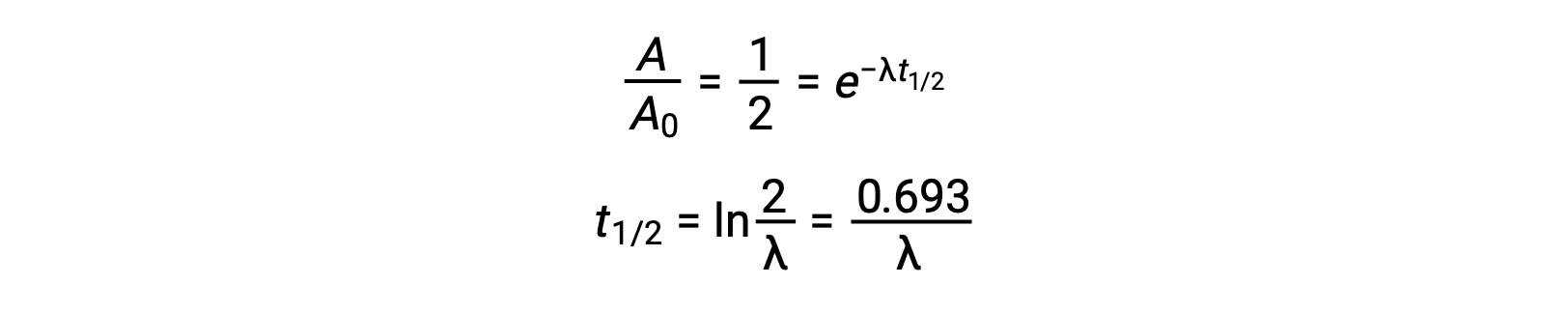
Un’emiglio è una proprietà intrinseca di un radionuclide, e ogni singolo atomo di un nuclide instabile ha la stessa emisolazione indipendentemente dal fatto che sia completamente solo nel vuoto o in un campione con molti altri atomi di quel nuclide. Le emili vite dei radionuclidi variano ampiamente: il radon-220 ha un’emidonna di 1 minuto: un milione di nuclei decadono fino a mezzo milione in un minuto e decadono ulteriormente fino a un quarto di milione in un altro minuto. Tuttavia, il torio-232 ha un’emi esperienza di 14 miliardi di anni.
Diversi radioisotopi hanno emicrani e altre proprietà che li rendono utili ai fini della “datazione” dell’origine temporale di oggetti come manufatti archeologici, organismi precedentemente viventi o formazioni geologiche.
Il carbonio-14, un radionuclide con un’emivizione di 5730 anni, fornisce un metodo per datare oggetti che facevano parte di un organismo vivente. Questo metodo di datazione radiometrica è accurato per la datazione di sostanze contenenti carbonio che hanno fino a circa 30.000 anni e possono fornire date ragionevolmente accurate fino a un massimo di circa 50.000 anni.
Il carbonio presente in natura è costituito da tre isotopi: carbonio-12, che costituisce circa il 99% del carbonio sulla terra; carbonio-13, circa l’1% del totale; e tracce di carbonio-14. Il carbonio-14 si forma nell’atmosfera superiore per reazione degli atomi di azoto con neutroni dai raggi cosmici nello spazio.
Tutti gli isotopi del carbonio reagiscono con l’ossigeno per produrre molecole di CO2. Pertanto, le piante viventi e gli animali hanno un rapporto tra carbonio-14 e carbonio-12 identico all’atmosfera. Ma quando la pianta vivente o l’animale muore, il rifornimento di carbonio si ferma, e il rapporto carbonio-14 a 12 inizia a diminuire man mano che il carbonio radioattivo-14 decade continuamente. Ad esempio, se il rapporto carbonio-14-carbonio-12 in un oggetto di legno trovato in uno scavo archeologico è la metà di quello che è in un albero vivente, questo suggerisce che l’oggetto è stato fatto di legno abbattuto 5730 anni fa. Determinazioni altamente accurate dei rapporti carbonio-14 e carbonio-12 possono essere ottenute da campioni molto piccoli (appena un milligrammo) utilizzando uno spettrometro di massa.
La datazione radioattiva può anche usare altri nuclidi radioattivi con emilità più lunghe fino ad oggi eventi più vecchi. Ad esempio, l’uranio-238, che decade in una serie di passaggi nel piombo-206, può essere usato per stabilire l’età delle rocce (e l’età approssimativa delle rocce più antiche sulla terra). Poiché l’uranio-238 ha un’emidità di 4,5 miliardi di anni, ci vuole quel periodo di tempo perché metà dell’uranio originale-238 decadi in piombo-206. In un campione di roccia che non contiene quantità apprezzabili di piombo-208, l’isotopo più abbondante del piombo, possiamo supporre che il piombo non fosse presente quando la roccia si è formata. Pertanto, misurando e analizzando il rapporto di U-238:Pb-206, possiamo determinare l’età della roccia. Ciò presuppone che tutto il piombo-206 presente sia venuto dal decadimento dell’uranio-238. Se è presente un lead-206 aggiuntivo, che è indicato dalla presenza di altri isotopi di piombo nel campione, è necessario effettuare un aggiustamento. La datazione potassio-argon usa un metodo simile. Il potassio-40 decade per emissione di positroni e cattura elettronica per formare argon-40 con un’emidità di 1,25 miliardi di anni. Se un campione di roccia viene schiacciato e viene misurata la quantità di gas argon-40 che fuorievi, la determinazione del rapporto Ar-40:K-40 produce l’età della roccia.
Questo testo è adattato da Openstax, Chemistry 2e, Section 21.3: Radioactive Decay.
