Summary
Hier wordt een methode beschreven om de bindingsaffiniteit (KD) van radioactief gelabelde antilichamen tegen geïmmobiliseerde antigenen te bepalen. KD is de evenwichtsdissociatieconstante die kan worden bepaald uit een verzadigingsbindingsexperiment door de totale, specifieke en niet-specifieke binding van een radioactief gelabeld antilichaam in verschillende concentraties aan zijn antigeen te meten.
Abstract
Het bepalen van bindingsaffiniteit (KD) is een belangrijk aspect van de karakterisering van radioactief gelabelde antilichamen (rAb). Typisch wordt bindingsaffiniteit weergegeven door de evenwichtsdissociatieconstante, KD, en kan worden berekend als de concentratie van antilichamen waarbij de helft van de antilichaambindingsplaatsen bij evenwicht bezet zijn. Deze methode kan worden gegeneraliseerd naar elk radioactief gelabeld antilichaam of andere eiwit- en peptidesteigers. In tegenstelling tot celgebaseerde methoden is de keuze van geïmmobiliseerde antigenen bijzonder nuttig voor het valideren van bindingsaffiniteiten na langdurige opslag van antilichamen, het onderscheiden van bindingsaffiniteiten van fragmentantigeenbindende regio (Fab) armen in bispecifieke antilichaamconstructies en het bepalen of er variabiliteit is in antigeenexpressie tussen verschillende cellijnen. Deze methode omvat het immobiliseren van een vaste hoeveelheid antigeen naar gespecificeerde putten op een breekbare 96-putplaat. Vervolgens werd de niet-specifieke binding in alle putten geblokkeerd met runderserumalbumine (BSA). Vervolgens werd de rAb in een concentratiegradiënt aan alle putten toegevoegd. Er werd gekozen voor een reeks concentraties om de rAb verzadiging te laten bereiken, d.w.z. een concentratie van antilichamen waarbij alle antigenen continu gebonden zijn door de rAb. In aangewezen putten zonder geïmmobiliseerd antigeen kan een niet-specifieke binding van de rAb worden bepaald. Door niet-specifieke binding af te trekken van de totale binding in de putten met geïmmobiliseerd antigeen, kan de specifieke binding van de rAb aan het antigeen worden bepaald. De KD van de rAb werd berekend uit de resulterende verzadigingsbindingscurve. Als voorbeeld werd bindingsaffiniteit bepaald met behulp van radioactief gelabelde amivantamab, een bispecifiek antilichaam voor epidermale groeifactorreceptor (EGFR) en cytoplasmatische mesenchymale-epitheliale overgang (cMET) eiwitten.
Introduction
Radioactief gelabelde antilichamen (rAb) hebben een verscheidenheid aan toepassingen in de geneeskunde. Hoewel de meerderheid in de oncologie wordt gebruikt als beeldvorming en therapeutische middelen, zijn er beeldvormingstoepassingen voor reumatologie-gerelateerde ontsteking, cardiologie en neurologie1. Imaging rAbs heeft een hoge gevoeligheid om laesies te detecteren en heeft het potentieel om te helpen bij de selectie van patiënten voor behandeling 2,3,4,5. Ze worden ook gebruikt voor therapie vanwege hun specificiteit voor hun respectieve antigenen. In een strategie die bekend staat als theranostica, wordt dezelfde rAb gebruikt voor zowel beeldvorming als behandeling6.
Idealiter is het antilichaam dat is gekozen voor radiolabeling een antilichaam waarvan al is bewezen dat het een hoge bindingsaffiniteit en specificiteit heeft met behulp van niet-radioactief gelabelde methoden. Radiolabeling van antilichamen kan worden bereikt via directe chemische modificatie van antilichamen met een radionuclide dat stabiele covalente bindingen vormt (bijv. radioactief jodium), of indirect via conjugatie met chelaatvormers die vervolgens coördineren met radiometalen 7,8. Directe radiolabeling zoals met radioactief jodium wijzigt specifiek tyrosine- en histidineresiduen op het antilichaam. Als deze residuen belangrijk zijn voor antigeenbinding, dan zou deze radioconjugatie de bindingsaffiniteit veranderen. Omgekeerd zijn er meerdere gevestigde protocollen voor de conjugatie en indirecte radiolabeling van antilichamen. Een veel voorkomende chelator die wordt gebruikt om zirkonium-89 (89Zr) te binden voor PET-beeldvorming van antilichamen is bijvoorbeeld de p-isothiocyanatobenzyl-desferrioxamine (DFO), die willekeurig wordt geconjugeerd aan lysineresiduen van het antilichaam 9,10. Als er lysineresiduen in het antigeenbindende gebied zijn, kan conjugatie op deze plaatsen sterisch de antigeenbinding belemmeren en daarom de antilichaam-antigeenbinding in gevaar brengen. De verschillende radioconjugatiemethoden die worden gebruikt voor indirecte of directe radiolabeling van antilichamen kunnen dus mogelijk de immunoreactiviteit beïnvloeden, gedefinieerd als het vermogen van het antilichaam radioconjugaat om te binden aan zijn antigeen 7,11. Locatiespecifieke conjugatiemethoden kunnen deze beperking omzeilen, maar deze technieken vereisen antilichaamtechnologie om extra cysteïneresiduen of expertise in enzymatische reacties op koolhydraatresiduen op te nemen 12,13,14,15,16. Zodra een antilichaam radioactief is gelabeld, is het belangrijk om te testen of immunoreactiviteit behouden blijft als onderdeel van de karakterisering van de rAb. Een manier om immunoreactiviteit te meten is het bepalen van de bindingsaffiniteit van de rAb.
Het doel van dit protocol is om een proces te beschrijven voor het bepalen van de bindingsaffiniteit voor rAbs met behulp van een gevestigde radioligand saturatietest om rAb-antigeenbinding te kwantificeren. De bindingstrend is weergegeven in figuur 1. De hoeveelheid antigeen gebonden zal toenemen naarmate meer rAb wordt toegevoegd aan een vaste hoeveelheid geïmmobiliseerd antigeen. Zodra alle antigeenbindplaatsen verzadigd zijn, zal een plateau worden bereikt en zal het toevoegen van meer rAbs geen effect hebben op de hoeveelheid gebonden antigeen. In dit model is de evenwichtsdissociatieconstante (KD) de concentratie van antilichamen die de helft van de antigeenreceptoren inneemt17. De KD geeft aan hoe goed een antilichaam zich bindt aan zijn doelwit met een lagere KD die overeenkomt met een hogere bindingsaffiniteit. Eerder werd gemeld dat een ideale rAb een KD van 1 nanomolair of minder18 zou moeten hebben. Recentere rAbs zijn echter ontwikkeld met KD in het lage nanomolaire bereik en worden geschikt geacht voor niet-invasieve beeldvormingstoepassingen 19,20,21,22. Een andere parameter die kan worden bepaald in de radioligand-verzadigingstest van rAbs is Bmax, wat overeenkomt met de maximale hoeveelheid antigeenbinding. Bmax kan worden gebruikt om het aantal antigeenmoleculen te berekenen indien nodig.

Figuur 1: Representatieve verzadigingsbindingscurve. Het percentage antigeen gebonden wordt uitgezet tegen toenemende concentraties antilichamen toegevoegd aan een vaste hoeveelheid antigeen. Pop-outs tonen binding op verschillende punten. De concentratie en binding die overeenkomen met respectievelijk KD en Bmax worden weergegeven. Deze figuur is gemaakt met BioRender.com. Klik hier om een grotere versie van deze figuur te bekijken.
Deze test is met name belangrijk voor radioactief gelabelde bispecifieke antilichaamconstructen om de KD te bepalen voor elke fragmentantigeenbindende regio (Fab) arm van de radioactief gelabelde bispecifieke antilichaambinding met hun respectieve antigenen. Dit protocol kan worden gebruikt om de KD van elke Fab-arm afzonderlijk op geïmmobiliseerde antigenen te bepalen om onafhankelijk te karakteriseren of de bindingsaffiniteit van elke Fab-arm voor zijn respectieve antigeen werd beïnvloed na radioconjugatie. Dit protocol wordt aangetoond door het gebruik van radioactief gelabelde amivantamab, een bispecifiek antilichaam voor epidermale groeifactorreceptor (EGFR) en cytoplasmatische mesenchymale-epitheliale overgang (cMET) eiwitten19. Radioactief gelabelde enkelarmige antilichamen, waarbij de ene Fab-arm bindt aan EGFR (α-EGFR) of aan cMET (α-cMET) en de andere Fab-arm een isotypecontrole is, werden ook gebruikt als voorbeelden19. Dit protocol is ook geschikt voor elk radioactief gelabeld antilichaam met een bekend antigeen dat kan worden geïmmobiliseerd. In dit protocol wordt een verdunningsreeks van de rAb toegevoegd aan een vaste hoeveelheid geïmmobiliseerd antigeen in aangewezen putten die specifiek zijn voor elke Fab-arm van de rAb. De rAb wordt ook toegevoegd aan putjes die alleen zijn geblokkeerd met runderserumalbumine (BSA), zonder antigeen, om niet-specifieke binding te bepalen. Om de specifieke binding te bepalen, wordt de niet-specifieke binding aan geïmmobiliseerd antigeen afgetrokken van de totale rAb-binding. De resulterende verzadigingsbindingscurve wordt vervolgens gebruikt om KD te bepalen, zoals hierboven beschreven.
Een voordeel van deze methode is een hogere reproduceerbaarheid bij het gebruik van gezuiverde antigenen in vergelijking met het gebruik van cellijnen als bron van antigenen, aangezien antigeenexpressieniveaus kunnen worden beïnvloed tijdens celkweek en dat verschillende cellijnen variabele niveaus van antigeenexpressie hebben. In het geval van radioactief gelabelde bispecifieke antilichamen zijn cellijnen die slechts één van de antigenen tot expressie brengen zonder de andere mogelijk niet beschikbaar, wat het karakteriseren van de bindingsaffiniteit van de individuele Fab-armen zeer uitdagend zou maken. Met name het belangrijkste voordeel van de radioligand saturatie-assaymethode ten opzichte van niet-radioactief gelabelde methoden is de specifieke karakterisering van de bindingsaffiniteit van de rAb zonder de bijdrage van de niet-geconjugeerde fractie van de rAb. Voor zover de auteurs weten, zijn er momenteel geen zuiveringstechnieken om de rAb te scheiden van zijn oorspronkelijke ongeconjugeerde antilichaam. Gezien de relatief kleine omvang van de chelator en radionuclide is hun bijdrage aan het totale molecuulgewicht van de rAb onbeduidend in grootte-uitsluitingschromatografie. Het product dat wordt gegenereerd door een radiolabelingstechniek is dus bijna altijd een mengsel van de rAb en het oorspronkelijke niet-geconjugeerde antilichaam. Het karakteriseren van bindingsaffiniteit met behulp van de radioactief gelabelde verzadigingstest zorgt ervoor dat het geteste product uitsluitend de rAb is.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
OPMERKING: Raadpleeg figuur 2 voor een grafische weergave van het protocol.

Figuur 2: Schema van het protocol. Rij- en kolomlabels worden aangegeven als leidraad voor het instellen van de breekbare 96-well plaat. De verwachte binding wordt weergegeven in een voorbeeldput voor het antigeen en het BSA. De gebogen pijl duidt de rAb aan die naar verwachting alleen met BSA uit putten zal worden weggespoeld. Deze figuur is gemaakt met BioRender.com. Klik hier om een grotere versie van deze figuur te bekijken.
1. Buffervoorbereiding
- Bereid 50 ml immobilisatiebuffer (waterige oplossing van 50 mM Na2CO3; pH = 9,0).
- Weeg 191 mg NaHCO3 en 23,9 mg Na2CO3 af op weegpapier en breng over op een conische buis van 50 ml. Voeg 40 ml 18 MΩ water en vortex toe om op te lossen. Stel de pH indien nodig in op 9,0 voordat u het totale volume met 18 MΩ water op 50 ml brengt.
- Bereid ongeveer 200 ml wasbuffer (fosfaat-gebufferde zoutoplossing (PBS) met 0,05% Tween-20) door 200 ml PBS en vervolgens 100 μL Tween-20 toe te voegen aan een fles van 250 ml.
- Bereid 50 ml bindingsbuffer (PBS met 0,05% Tween-20 en 0,1% runderserumalbumine (BSA)).
- Weeg 50 mg BSA af op weegpapier en breng over op een conische buis van 50 ml. Voeg 50 ml PBS en vervolgens 25 μl Tween-20 toe aan de buis. Vortex voorzichtig mengen.
- Bereid 50 ml blokkeringsbuffer voor (3% BSA in PBS).
- Weeg 1,5 g BSA af op weegpapier en breng over op een conische buis van 50 ml. Voeg 50 ml PBS toe en vortex voorzichtig om te mengen.
OPMERKING: Alle buffers worden aanbevolen om maximaal 1 week bij 4 °C te worden bewaard voor het beste resultaat.
- Weeg 1,5 g BSA af op weegpapier en breng over op een conische buis van 50 ml. Voeg 50 ml PBS toe en vortex voorzichtig om te mengen.
2. Immobilisatie van antigeen
- Verdun het antigeen in immobilisatiebuffer tot een concentratie van 5 μg/ml.
- Voeg 100 μL per put antigeen toe aan de bodem van 24 putten van een breekbare plaat met 96 putten en een vlakke bodem in een array van 8 x 3 (kolommen 1-3 voor rijen A-H). Bedek de plaat met afdichtingstape.
OPMERKING: Zorg ervoor dat het oppervlak van de putplaat is behandeld om de adsorptie van gemengde hydrofobe en hydrofiele domeinen te maximaliseren. Deze voorbehandelde platen zijn in de handel verkrijgbaar. - Incubeer 's nachts bij 4 °C.
- Was het bord de volgende dag 3x met wasbuffer.
- Keer de plaat stevig om in de gootsteen om de vloeistof weg te gooien en tik op de plaat op een stapel papieren handdoeken om de overtollige vloeistof te verwijderen.
- Voeg met behulp van een meerkanaalspoptiet 300 μL per putje wasbuffer toe aan putten die het antigeen bevatten. Verwijder de vloeistof zoals beschreven in punt 2.4.1. Herhaal de wasstap in totaal drie keer.
3. Blokkeren van niet-specifieke sites met BSA
- Voeg met behulp van een meerkanaalspion 300 μL per put blokkeerbuffer toe aan de 24 met antigeen beklede putten en 24 lege putten van de 96-putplaat (kolommen 1-6 voor rijen A-H).
- Incubeer de plaat gedurende 1 uur bij omgevingstemperatuur.
- Was de plaat met 300 μL per putje wasbuffer in totaal drie keer. Raadpleeg stap 2.4 voor een gedetailleerde beschrijving van het wassen van de plaat.
4. Seriële verdunningen en toevoeging van de rAb-oplossing
LET OP: De volgende stappen hebben betrekking op radioactiviteit. Stappen mogen alleen worden uitgevoerd door mensen met een stralingsveiligheidstraining. Onderzoekers moeten de handschoen verdubbelen en stappen uitvoeren met voldoende afscherming.
- Synthetiseer de rAb die wordt onderzocht met behulp van de methode van keuze. De rAbs die als voorbeeld werden gebruikt, werden gesynthetiseerd zoals eerder beschreven19.
OPMERKING: Dit protocol richt zich op de karakterisering van een rAb eenmaal radioactief gelabeld. - Maak 8 x 3-voudige seriële verdunningen (aangewezen voor rijen A-H op de plaat) van de rAb in de bindingsbuffer.
OPMERKING: De concentraties van de seriële verdunningen variëren voor elke rAb. Details worden besproken in de sectie Discussie. Als de verdunningsfactor verandert, moet het volume dat nodig is voor elke verdunning opnieuw worden berekend om te zorgen voor voldoende volume voor 1) binding van de rAb in elke put, 2) het zaaien van de volgende verdunning en 3) het aliquoteren van een rAb-standaardoplossing voor gammatellingen om de radioactiviteit van de totale rAb die aan elke put wordt toegevoegd te meten.- Bereken het volume voorraad rAb dat nodig is om een oplossing van 1,2 ml van de eerste concentratie te maken (etiket als A).
- Voeg 800 μL bindingsbuffer toe aan microcentrifugebuizen met het label B, C, D, ... aan H. Voeg 1,2 ml minus het in stap 4.2.1 berekende volume van de bindingsbuffer toe aan een microcentrifugebuis met het label A.
- Tel het volume voorraad rAb berekend in 4.2.1 op bij buis A. Vortex voorzichtig te mengen en draai vervolgens naar beneden met behulp van een mini-microcentrifuge om alle vloeistof op de bodem van de buis te verzamelen.
- Voeg 400 μL toe van buis A naar buis B. Vortex om te mengen en vervolgens af te draaien met behulp van een mini-microcentrifuge. Herhaal het toevoegen van B naar C, C naar D, ..., G naar H.
- Voeg 100 μL per put van elke verdunning toe aan drie putjes geïmmobiliseerd met antigeen en drie putjes geblokkeerd met alleen BSA. Voeg bijvoorbeeld verdunning A toe aan putjes A1-A3 (antigeen) en A4-A6 (BSA).
- Voeg 100 μL van elke verdunning toe aan microcentrifugebuizen met het label A std - H std. Bewaar deze buizen als rAb-normen die moeten worden getest in de gammateller.
- Incubeer de plaat gedurende 1 uur bij 37 °C met zacht wiegen.
5. Wasplaten en testradioactiviteit
- Label microcentrifugebuizen voor elke put (A1 tot A6, B1 tot B6 ... via H1-H6). Gebruik indien gewenst twee verschillende gekleurde markers om monsters te kleuren - één voor putten bedekt met antigeen en één voor putten met alleen BSA.
- Aspirateer de rAb uit elke put met behulp van een vacuümaspirator.
- Voeg met behulp van een meerkanaalspoptie 300 μL wasbuffer toe aan elke put. Zuig de wasbuffer op. Herhaal de was in totaal vijf keer.
- Breek de putten uit elkaar in de juiste microcentrifugebuizen.
- Tel de radioactiviteit in de buizen met behulp van een gammateller. Tel eerst de buizen met het antigeen (H1, H2, H3 tot A1, A2, A3) en vervolgens die met alleen BSA (H4, H5, H6 tot A4, A5, A6). Om interferentie te minimaliseren, telt u afzonderlijk de normen voor elke verdunning (H std tot A std) op een ander tijdstip.
6. Data-analyse
OPMERKING: De aanvullende bestanden bevatten bijbehorende spreadsheet- en statistische analysesjablonen voor het analyseren en plotten van de gegevens.
- Bereken in een spreadsheet de totale, specifieke en niet-specifieke binding voor elk voorbeeld (zie de spreadsheetsjabloon die als aanvullend bestand is bijgevoegd).
- Bereken "Gebonden activiteit" als de tellingen per minuut (CPM) van het monster (verkregen uit de gammateller) gedeeld door de CPM van de juiste standaard. Bereken "% Gebonden" als Gebonden Activiteit maal 100.
- Bereken "Total Bound, mol/L" door "% Bound" te vermenigvuldigen met de concentratie (mol/L) van de toegevoegde rAb. Bereken "Total Bound, mol" door "Total Bound, mol/L" te vermenigvuldigen met het volume rAb toegevoegd in liters (0,0001 L).
- Bereken "Specifieke Binding, mol" door "Totaal gebonden, mol" van de BSA-verdunningen van de antigeenverdunningen af te trekken, zodat A1 paart met A4, A2 met A5, A3 met A6, B1 met B4, enz.
- Bereken "Niet-specifieke binding, mol" door "Specifieke binding, mol" af te trekken van "Totale binding, mol" voor elke put.
- Zet in de statistische analyse plotting software de concentratie van rAb toegevoegd (nmol/L) op de x-as versus binding (mol) op de y-as. Maak afzonderlijke groepen om te plotten in drievoudige totale binding, specifieke binding en niet-specifieke binding. Voer een niet-lineaire fitanalyse uit door de volgende parameters in de gebruikte software te selecteren (Tabel met materialen; zie de statistische analysesjabloon die als aanvullend bestand is bijgevoegd).
- Selecteer Nieuwe analyse. Selecteer onder XY-analyses de optie Niet-lineaire regressie (curve fit). Zorg ervoor dat alle gegevens zijn geselecteerd onder Welke gegevenssets analyseren? en selecteer vervolgens OK.
- Selecteer op het tabblad Model onder Binding - Verzadiging de optie Eén site - Specifieke binding. Selecteer op het tabblad Vertrouwen de optie 'dubbelzinnige' pasvormen identificeren. Laat alle andere parameters als standaard staan en selecteer OK.
OPMERKING: Hiermee worden de KD en Bmax berekend voor de totale, specifieke en niet-specifieke binding. De KD van de specifieke binding is de KD in nmol/L van de rAb gebonden aan het antigeen.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Deze methode berekent bindingsaffiniteit (KD) voor een rAb op basis van de verzadigingsbindingstest waarbij verschillende concentraties rAb werden toegevoegd aan een vaste hoeveelheid geïmmobiliseerd antigeen. De bindingscurve moet logaritmische groei volgen waar deze aanvankelijk steil is en vervolgens plateaus als het antigeen verzadigd is. Om ervoor te zorgen dat de vastgestelde KD nauwkeurig is, moeten de concentraties rAb hoog genoeg zijn om verzadiging te bereiken. Voor deze test werden radioactief gelabelde antilichamen geconjugeerd aan DFO en radioactief gelabeld met 89Zr, zoals eerder beschreven19. Figuur 3 toont representatieve verzadigingsbindingspercelen. Radioactief gelabeld amivantamab, een bispecifiek antilichaam voor epidermale groeifactorreceptor (EGFR) en cytoplasmatisch mesenchymaal-epitheliaal overgangseiwit (cMET), was gebonden aan EGFR (figuur 3A) en cMET (figuur 3B) eiwitten19. Verzadigingsbindingsdiagrammen worden ook getoond voor de enkelarmige radioactief gelabelde Fabs gebonden aan EGFR (figuur 3C) en cMET (figuur 3D) eiwitten19. In alle subfiguren waren niet-lineaire regressiecurven representatief voor de verdunningsreeksen met minimale uitschieters van de krommen. Specifieke binding kwam overeen met het grootste deel van de totale binding. Hoewel de niet-specifieke binding over het algemeen laag was, vertoonden hogere concentraties rAb een grotere niet-specifieke binding, wat wijst op een mogelijke drempel voor niet-specifieke binding in deze test. De bindingsaffiniteiten van de rAbs lagen in het verwachte nanomolaire bereik. De KD-waarden van 8,4 ± 1,7 nM en 4,2 ± 1,5 nM voor respectievelijk de enkelarmige α-EGFR en α-cMET vertonen een vergelijkbare affiniteit voor het doelantigeen als de bispecifieke rAb met KD-waarden van respectievelijk 9,9 ± 2,1 nM en 16,9 ± 5,9 nM voor EGFR en cMET.
Suboptimale experimenten voor de binding van radioactief gelabelde α-cMET aan geïmmobiliseerde cMET-eiwitten worden getoond in figuur 4 om de resultaten aan te tonen van parameters die moeten worden geoptimaliseerd. In figuur 4A was het concentratiebereik van de toegevoegde rAb te laag en werd de verzadiging niet bereikt, zoals blijkt uit het feit dat de bindingscurve geen plateau bereikte. Deze omstandigheden resulteerden in een lineaire plot van de concentratie van rAb toegevoegd versus gebonden rAb. Omdat de gegevens niet passen bij het niet-lineaire regressiemodel, werd de KD-waarde in de statistische analyse als "dubbelzinnig" bepaald. In figuur 4B werden te hoge concentraties gebruikt voor radioactief gelabelde α-cMET. De verzadiging werd bereikt zoals aangegeven door het horizontale plateau van de bindingskromme. Niet-specifieke binding draagt echter merkbaar bij aan de totale binding. Deze omstandigheden resulteren in een hoge mate van onzekerheid aangegeven door een KD-waarde van 14,9 nM met een groot 95% betrouwbaarheidsinterval van 4,8 - 44,2 nM. Het optimaliseren van het toegevoegde concentratiebereik van rAb, zoals weergegeven in figuur 3D, zou dus nauwkeurigere KD-waarden opleveren. De verzadigingsbindingscurve is gebaseerd op de Michaelis-Mentenvergelijking voor reactiekinetiek. Een curve past goed wanneer de punten willekeurig zijn verdeeld over de regressielijn17. Een smal betrouwbaarheidsinterval geeft aan dat de KD-waarde nauwkeurig is.

Figuur 3: Verzadigingsbindingspunten om KD te bepalen. Bindingscurven van [89Zr]Zr-DFO-amivantamab aan (A) EGFR- en (B) cMET-eiwitten, (C) [89Zr]Zr-DFO-α-EGFR aan EGFR-eiwit en (D) [89Zr]Zr-DFO-α-cMET aan cMET-eiwitten om bindingsaffiniteit te berekenen. Foutbalken vertegenwoordigen de standaarddeviatie van gebonden 89Zr-gelabeld antilichaam voor elke concentratie. Gemiddelde ± SD van KD en Bmax worden getoond uit drie onafhankelijke experimenten voor elke aandoening. Dit cijfer wordt hergebruikt met toestemming van Cavaliere et al19. Klik hier om een grotere versie van deze figuur te bekijken.
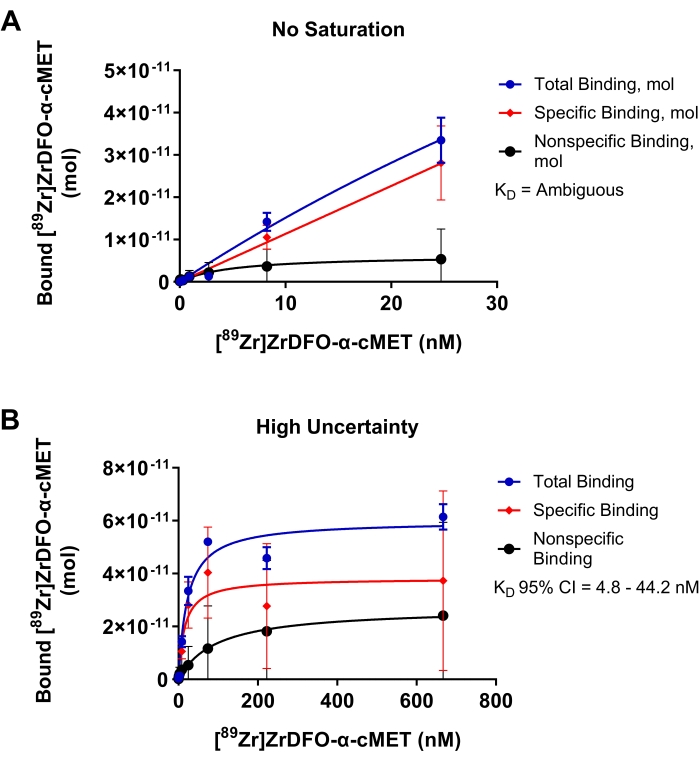
Figuur 4: Verzadigingsbindingspercelen waarbij KD niet nauwkeurig kan worden bepaald. Binding van [89Zr]Zr-DFO-α-cMET aan cMET-eiwitten. Foutbalken vertegenwoordigen de standaarddeviatie van gebonden [89Zr]Zr-DFO-α-cMET. (A) De concentraties van [89Zr]Zr-DFO-α-cMET zijn te laag en de verzadiging wordt niet bereikt. KD kan niet worden berekend omdat de curve lineair is en niet past in het niet-lineaire regressiemodel. (B) Grote onzekerheid voor de specifieke binding wordt aangegeven door het brede 95%-betrouwbaarheidsinterval (BI) voor KD (4,8-44,2 nM). Er is ook een hoge niet-specifieke binding als gevolg van hoge concentraties rAb. Klik hier om een grotere versie van deze figuur te bekijken.
Aanvullende bestanden. Klik hier om dit bestand te downloaden.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Als onderdeel van de ontwikkeling van rAbs is het belangrijk om ervoor te zorgen dat een rAb specifiek bindt aan zijn doel met een hoge bindingsaffiniteit. Het bepalen van de bindingsaffiniteit kan aangeven of de immunoreactiviteit van de rAb wordt beïnvloed door radioconjugatie via de radioligand saturatietest met behulp van geïmmobiliseerd antigeen. Het bepalen van de rAb-binding aan BSA kan worden gebruikt om niet-specifieke binding te kwantificeren om de specifieke binding aan het geïmmobiliseerde antigeen nauwkeuriger te meten. Deze methode test de binding van verschillende concentraties rAb om een verzadigingsbindingscurve te genereren om de KD te berekenen en de bindingsaffiniteit te bepalen.
Om deze test uit te voeren, moet men het antigeen voor de rAb in onderzoek hebben. Het antigeen moet de epitoop hebben waaraan het antilichaam bindt. In situaties waarin nieuwe antilichamen onbekende bindende epitopen hebben, kunnen niet-radioactief gelabelde methoden voor het bepalen van bindingsaffiniteit geschikter zijn. Voordat met het experiment wordt begonnen, wordt een literatuuronderzoek aanbevolen. Antigenen van belang die eerder zijn gebruikt in ELISA-gebaseerde assays zijn waarschijnlijk effectief voor deze assay.
Afhankelijk van de halfwaardetijd van de radionuclide en de gevoeligheid van de gammateller, kan het enige tijd duren voordat de normen vervallen tot een niveau van radioactiviteit dat binnen de kwantitatieve grenzen van de gammateller ligt. Als het niveau van radioactiviteit naar verwachting te hoog is voor de gammateller, verdunt u de standaardmonsters en vermenigvuldigt u deze vervolgens met de verdunningsfactor in de gegevensanalyse. Deze stap moet worden uitgevoerd op de dag van het experiment om de mogelijkheid van antilichaamaggregatie of -afbraak te voorkomen die zou kunnen leiden tot inhomogene standaardoplossingen en onnauwkeurige aflezing.
Het genereren van een goed gevormde verzadigingscurve is gebaseerd op de gekozen verdunningsreeks. Dit proces vereist vallen en opstaan. Het onvermogen om de concentraties van rAbs te generaliseren is een beperking van het protocol, omdat van alle rAbs wordt verwacht dat ze verschillende bindingsaffiniteiten hebben voor hun antigenen. Dit protocol moet worden geoptimaliseerd voor elke rAb. Eenmaal geoptimaliseerd, moet het protocol reproduceerbaar zijn voor de specifieke rAb. Zowel het concentratiebereik als de verdunningsfactor moeten mogelijk worden aangepast op basis van de vorm van de curve. Gezien het verwachte nanomolaire bereik voor antilichaambinding, zal het starten met de breedst mogelijke weergave van dit bereik het mogelijk maken om in te zoomen op een smaller concentratiebereik dat van belang is voor toekomstige proeven. In plaats van acht seriële verdunningen zouden zestien meer gegevenspunten opleveren om het bindingsbereik te begrijpen. Als de KD van het ongeconjugeerde antilichaam bekend is, wordt aanbevolen om die waarde te gebruiken als een middelste concentratie van het bereik bij het eerste ontwerpen van het onderzoek. Afhankelijk van de beschikbaarheid van materialen kan het protocol relatief sneller worden geoptimaliseerd door meerdere lopende onderzoeken met verschillende concentratiebereiken en verdunningsfactoren. De incubatietijd kan worden aangepast om ervoor te zorgen dat de verzadiging wordt bereikt. Bovendien, als de binding laag is, zelfs bij verzadiging, is er mogelijk niet genoeg signaalbereik om de KD nauwkeurig te berekenen. Het optimaliseren van de concentratie van geïmmobiliseerd antigeen kan nodig zijn. Een vooronderzoek kan worden uitgevoerd met verschillende concentraties geïmmobiliseerd antigeen en de voorraadconcentratie van rAb om het maximale bindingssignaal te bepalen.
Radioligand saturatie assay is een gevestigde methode en heeft veel voordelen, vergeleken met andere niet-radioactief gelabelde methoden zoals flowcytometrie of oppervlakte plasmon resonantie (SPR), voor het bepalen van de bindingsaffiniteit van rAbs. Methoden die gebruikmaken van de detectie van niet-radioactief gelabelde antilichamen bepalen de bindingsaffiniteit van een gemengd monster dat bestaat uit zowel de geconjugeerde als de niet-geconjugeerde antilichamen. In radioligand saturatietest is het enige geregistreerde signaal dat van het radioactief gelabelde antilichaamconjugaat, dat een nauwkeuriger KD levert voor de radioactief gelabelde soorten die de biomedische toepassing zouden beïnvloeden. Deze overweging maakt de resultaten van radioligand saturatie assay en die van niet-radioactief gelabelde technieken praktisch onvergelijkbaar omdat ze verschillende monsters meten - rAb vs. rAb plus ouderlijk antilichaam. Eén studie vergeleek de bindingsaffiniteit van niet-radioactief gelabeld antilichaam-chelatorconjugaat en het ouderlijk bispecifiek antilichaam met SPR op geïmmobiliseerde eiwitten. Er was een vijfvoudig verschil tussen de KD-waarden van het antilichaam-chelatorconjugaat en het ouderlijk antilichaam. Het verschil in KD-waarden gevonden tussen SPR en een verzadigingstest op meerdere cellijnen varieerde van 10- tot 1.000-voudig23. Het niet-radioactief gelabelde antilichaam-chelator is een mengsel van geconjugeerde en ongeconjugeerde antilichamen, terwijl de KD-waarden bepaald door de verzadigingstest alleen afkomstig zijn van het radioactief gelabelde geconjugeerde antilichaam. Er is ook variatie in antigeenexpressie tussen de gebruikte cellijnen. Niet-radioactief gelabelde technieken kunnen dus niet worden gebruikt om de radioligand-verzadigingstest te valideren. Zodra de KD van de rAb is bepaald, kan echter een competitieve bindingstest worden uitgevoerd om verschillen in binding tussen de ouderlijke en geconjugeerde varianten van het antilichaam17,21 te bepalen.
De radioligand saturatietest kan worden uitgebreid om de verzadigingsbinding van de rAb aan cellen te bepalen in plaats van geïmmobiliseerd antigeen. Met behulp van dezelfde concepten kunnen verschillende concentraties rAb worden toegevoegd aan een vast aantal cellen. De data-analyse die in het protocol wordt beschreven, kan vervolgens worden gebruikt om de bindingsaffiniteit van de rAb aan de cellen te bepalen, die ook Bmax zou bepalen om het aantal antigeenmoleculen te berekenen dat aanwezig is op de cellijn van belang. Deze methode kan ook worden gegeneraliseerd naar andere radioactief gelabelde eiwit- en peptidesteigers om hun specifieke binding aan hun doelen te bepalen. Concluderend beschrijft dit protocol het proces van het bepalen van de bindingsaffiniteit van rAbs aan geïmmobiliseerde eiwitantigenen. Het proces maakt gebruik van basislaboratoriumtechnieken om seriële verdunningen van de rAb te maken om toe te voegen aan het geïmmobiliseerde antigeen. Het meest uitdagende aspect is het bepalen van de concentraties van de rAb om een goed gevormde verzadigingsbindende curve te genereren. Dit proces vereist vallen en opstaan in de ontwikkeling van de test voor individuele rAbs, maar zou dan reproduceerbaar zijn zodra het is vastgesteld. De berekende KD kan worden gebruikt als een metriek van immunoreactiviteit als criterium om verder te gaan met beeldvormings- of therapietoepassingen, of om de antilichaam-chelaatconjugatiereactie te verfijnen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben geen belangenverstrengeling.
Acknowledgments
De auteurs bedanken 3D Imaging voor de productie van [89Zr]Zr-oxalaat en Dr. Sheri Moores van Janssen Pharmaceuticals voor het leveren van antilichamen.
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P. Radioligand binding assays and their analysis. in Receptor Binding Techniques. Davenport, A. P. , Humana Press. 31-77 (2012).
- Davenport, A. P., Russell, F. D. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. Mather, S. J. , Springer. Netherlands. 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).



