Summary
כאן מתוארת שיטה לקביעת הזיקה המחייבת (KD) של נוגדנים בעלי תווית רדיו לאנטיגנים משותקים. KD הוא קבוע דיסוציאציית שיווי המשקל שניתן לקבוע מניסוי קשירת רוויה על ידי מדידת הקשירה הכוללת, הספציפית והלא ספציפית של נוגדן בעל תווית רדיו בריכוזים שונים לאנטיגן שלו.
Abstract
קביעת זיקה מקשרת (KD) היא היבט חשוב של אפיון נוגדנים בעלי תווית רדיו-תווית (rAb). בדרך כלל, זיקה מקשרת מיוצגת על ידי קבוע הדיסוציאציה של שיווי המשקל, KD, וניתן לחשב אותה כריכוז הנוגדן שבו מחצית מאתרי הקישור של הנוגדנים תפוסים בשיווי משקל. ניתן להכליל שיטה זו לכל נוגדן בעל תווית רדיו או פיגומים אחרים של חלבונים ופפטידים. בניגוד לשיטות מבוססות תאים, הבחירה באנטיגנים משותקים שימושית במיוחד לאימות זיקות קושרות לאחר אחסון ארוך טווח של נוגדנים, הבחנה בין זיקות קשירת קשר של זרועות אזור קושר אנטיגן מקטעי (Fab) במבני נוגדנים דו-ספציפיים, וקביעה אם יש שונות בביטוי אנטיגן בין קווי תאים שונים. שיטה זו כוללת שיתוק כמות קבועה של אנטיגן לבארות שצוינו על לוחית 96 בארות הניתנת לשבירה. לאחר מכן, קשירה לא ספציפית נחסמה בכל הבארות עם אלבומין בסרום בקר (BSA). לאחר מכן, rAb נוסף בשיפוע ריכוז לכל הבארות. מגוון של ריכוזים נבחר כדי לאפשר ל-rAb להגיע לרוויה, כלומר ריכוז של נוגדנים שבו כל האנטיגנים קשורים באופן רציף על ידי ה-rAb. בבארות ייעודיות ללא אנטיגן משותק, ניתן לקבוע קשירה לא ספציפית של ה- rAb. על ידי חיסור קשירה לא ספציפית מהקשירה הכוללת בבארות עם אנטיגן משותק, ניתן לקבוע קשירה ספציפית של rAb לאנטיגן. KD של rAb חושב מתוך עקומת קשירה רוויה שנוצרה כתוצאה מכך. לדוגמה, זיקה מקשרת נקבעה באמצעות amivantamab עם תווית רדיו-תאית, נוגדן דו-ספציפי לקולטן גורם גדילה אפידרמלי (EGFR) וחלבוני מעבר מזנכימלי-אפיתליאלי ציטופלסמי (cMET).
Introduction
לנוגדנים בעלי תווית רדיו (rAb) יש מגוון שימושים ברפואה. בעוד שרובם משמשים באונקולוגיה כחומרי הדמיה וטיפול, ישנם יישומי הדמיה לדלקת הקשורה לראומטולוגיה, קרדיולוגיה ונוירולוגיה1. הדמיה rAbs יש רגישות גבוהה לאיתור נגעים ויש לו פוטנציאל לסייע בבחירת המטופלים לטיפול 2,3,4,5. הם משמשים גם לטיפול בגלל הספציפיות שלהם עבור האנטיגנים שלהם בהתאמה. באסטרטגיה המכונה תרנוסטיקה, אותו rAb משמש הן להדמיה והן לטיפול6.
באופן אידיאלי, הנוגדן שנבחר לתיוג רדיו הוא כזה שכבר הוכח כבעל זיקה וספציפיות מחייבת גבוהה בשיטות שאינן מתויגות. ניתן להשיג סימון רדיו של נוגדנים באמצעות שינוי כימי ישיר של נוגדנים עם רדיונוקליד היוצר קשרים קוולנטיים יציבים (למשל רדיו-יוד), או בעקיפין באמצעות הצמדה עם כלאטורים שמתואמים לאחר מכן לרדיומטלים 7,8. תיוג רדיו ישיר כגון עם רדיויוד משנה באופן ספציפי את שאריות הטירוזין וההיסטידין על הנוגדן. אם שאריות אלה חשובות לקשירת אנטיגן, אזי זיקת רדיו זו תשנה את זיקת הכריכה. לעומת זאת, ישנם פרוטוקולים מבוססים מרובים להצמדה ותווי רדיו-תיוג עקיף של נוגדנים. לדוגמה, כלטור נפוץ המשמש לקשירת זירקוניום-89 (89Zr) להדמיית PET של נוגדנים הוא p-isothiocyanatobenzyl-desferrioxamine (DFO), אשר מצומד באופן אקראי לשאריות ליזין של הנוגדן 9,10. אם יש שאריות ליזין באזור קשירת האנטיגן, הצמדה באתרים אלה עלולה לעכב באופן סטריקי את קשירת האנטיגן ובכך לפגוע בקשירת הנוגדן-אנטיגן. לפיכך, שיטות הרדיו-קונז'וגציה השונות המשמשות לתיוג רדיו-תיוג עקיף או ישיר של נוגדנים עלולות להשפיע על פעילות חיסונית, המוגדרת כיכולתו של הנוגדן רדיו-קונג'וגאט להיקשר לאנטיגן 7,11 שלו. שיטות הצמדה ספציפיות לאתר יכולות לעקוף מגבלה זו, אך טכניקות אלה דורשות הנדסת נוגדנים כדי לשלב שאריות ציסטאין נוספות או מומחיות בתגובות אנזימטיות על שאריות פחמימות 12,13,14,15,16. ברגע שנוגדן מתויג, חשוב לבדוק אם פעילות חיסונית נשמרת כחלק מהאפיון של ה-rAb. אחת הדרכים למדוד את האימונו-פעילות החיסונית היא לקבוע את הזיקה המחייבת של rAb.
מטרת פרוטוקול זה היא לתאר תהליך לקביעת זיקת האיגוד עבור rAbs באמצעות מבחן רוויה רדיוליגנד מבוסס כדי לכמת את קשירת rAb-antigen. מגמת הכריכה מתוארת באיור 1. כמות האנטיגן הקשורה תגדל ככל שיתווסף יותר rAb לכמות קבועה של אנטיגן משותק. ברגע שכל האתרים הקושרים אנטיגן יהיו רוויים, תגיע מישור, והוספת rAbs נוספים לא תשפיע על כמות האנטיגן הכבול. במודל זה, קבוע הדיסוציאציה של שיווי המשקל (KD) הוא ריכוז הנוגדן התופס מחצית מקולטני האנטיגן17. ה-KD מייצג עד כמה נוגדן נקשר למטרה שלו עם KD נמוך יותר המתאים לזיקה מחייבת גבוהה יותר. בעבר דווח כי rAb אידיאלי צריך להיות KD של 1 ננומולאר או פחות18. עם זאת, rAbs עדכניים יותר פותחו עם KD בתחום הננומולרי הנמוך, ונחשבים מתאימים ליישומי הדמיה לא פולשניים 19,20,21,22. פרמטר נוסף שניתן לקבוע בבדיקת הרוויה הרדיוליגנדית של rAbs הוא Bmax, אשר מתאים לכמות המרבית של קשירת אנטיגן. ניתן להשתמש ב-Bmax כדי לחשב את מספר מולקולות האנטיגן במידת הצורך.

איור 1: עקומת קשירה מייצגת של רוויה. אחוז האנטיגן הקשור מתווה כנגד ריכוזים הולכים וגדלים של נוגדנים שנוספו לכמות קבועה של אנטיגן. חלונות קופצים מדגימים קשירה בנקודות שונות. הריכוז והקשירה המתאימים ל- KD ו- Bmax, בהתאמה, מוצגים. דמות זו נוצרה עם BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
בדיקה זו חשובה במיוחד עבור מבני נוגדנים דו-ספציפיים בעלי תווית רדיו כדי לקבוע את ה-KD עבור כל אזור קושר אנטיגן מקטעי (Fab) של זרוע הנוגדן הדו-ספציפי בעל התוויות הרדיו-תוויות עם האנטיגנים המתאימים שלהם. פרוטוקול זה יכול לשמש כדי לקבוע את KD של כל זרוע Fab בנפרד על אנטיגנים משותקים כדי לאפיין באופן עצמאי אם הזיקה המחייבת של כל זרוע Fab עבור האנטיגן המתאים שלה הושפעה לאחר רדיו-קונסיגנציה. פרוטוקול זה מודגם על ידי שימוש ב- amivantamab עם תווית רדיו- radiolabeled, נוגדן דו-ספציפי לקולטן גורם גדילה אפידרמלי (EGFR) וחלבוני מעבר מזנכימלי-אפיתל ציטופלסמי (cMET)19. נוגדנים חד-זרועיים בעלי תווית רדיו, כאשר זרוע Fab אחת נקשרת ל-EGFR (α-EGFR) או ל-cMET (α-cMET) וזרוע ה-Fab השנייה היא בקרת איזוטיפ, שימשו גם הם כדוגמאות19. פרוטוקול זה מתאים גם לכל נוגדן עם תווית רדיו עם אנטיגן ידוע שיכול להיות משותק. בפרוטוקול זה, סדרת דילול של ה-rAb מתווספת לכמות קבועה של אנטיגן משותק בבארות ייעודיות ספציפיות לכל זרוע Fab של ה-rAb. ה-rAb מתווסף גם לבארות שנחסמו רק עם אלבומין בסרום בקר (BSA), ללא אנטיגן, כדי לקבוע קשירה לא ספציפית. כדי לקבוע קשירה ספציפית, קשירה לא ספציפית לאנטיגן משותק מופחתת מהכריכה הכוללת של rAb. עקומת קשירת הרוויה המתקבלת משמשת לאחר מכן לקביעת KD, כמתואר לעיל.
אחד היתרונות של שיטה זו הוא יכולת שכפול גבוהה יותר בעת שימוש באנטיגנים מטוהרים בהשוואה לשימוש בקווי תאים כמקור לאנטיגנים, בהתחשב בכך שרמות ביטוי אנטיגן עלולות להיות מושפעות במהלך תרבית תאים וכי לקווי תאים שונים יש רמות משתנות של ביטוי אנטיגן. במקרה של נוגדנים דו-ספציפיים בעלי תווית רדיולית, קווי תאים המבטאים רק אחד מהאנטיגנים ללא השני עשויים שלא להיות זמינים, מה שיהפוך את אפיון הזיקה המחייבת של זרועות ה-Fab הבודדות למאתגר מאוד. יש לציין כי היתרון העיקרי של שיטת בדיקת הרדיוליגנד והרוויה על פני שיטות שאינן מתויגות ברדיו הוא האפיון הספציפי של הזיקה המחייבת של ה-rAb ללא התרומה של השבר הלא-מתויג של ה-rAb. למיטב ידיעתם של המחברים, אין כיום טכניקות טיהור להפרדת ה-rAb מהנוגדן הלא-משועבד שלו. בהתחשב בגודל הקטן יחסית של הצ'לטור והרדיונוקליד, תרומתם למשקל המולקולרי הכולל של ה-rAb אינה משמעותית בכרומטוגרפיה של הרחקת גודל. לפיכך, המוצר שנוצר מכל טכניקת radiolabeling הוא כמעט תמיד תערובת של rAb ואת ההורה שלה נוגדן unjujugated. אפיון זיקה מחייבת באמצעות בדיקת הרוויה עם תווית הרדיו מבטיח שהמוצר הנבדק הוא אך ורק rAb.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
הערה: עיין באיור 2 לקבלת ייצוג גרפי של הפרוטוקול.

איור 2: שרטוט של הפרוטוקול. תוויות שורות ועמודות מסומנות כמדריך להגדרת הלוח הניתן לשבירה של 96 בארות. הכריכה הצפויה מוצגת בדוגמה היטב עבור האנטיגן וה- BSA. החץ המעוקל מציין את ה-rAb שצפוי להישטף מבארות עם BSA בלבד. דמות זו נוצרה עם BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
1. הכנת מאגר
- הכן 50 מ"ל של חיץ אימוביליזציה (תמיסה מימית של 50 mM Na2CO3; pH = 9.0).
- שוקלים 191 מ"ג של NaHCO3 ו-23.9 מ"ג של Na2CO3 על נייר שקילה ומעבירים לצינור חרוטי של 50 מ"ל. מוסיפים 40 מ"ל של 18 MΩ מים ומערבולת כדי להתמוסס. התאם את ה- pH ל- 9.0 במידת הצורך לפני שתביא את הנפח הכולל ל- 50 מ"ל עם 18 MΩ מים.
- הכינו כ-200 מ"ל של מאגר כביסה (מי מלח עם חציית פוספט (PBS) המכילים 0.05% Tween-20) על ידי הוספת 200 מ"ל של PBS ולאחר מכן 100 μL של Tween-20 לבקבוק של 250 מ"ל.
- הכינו 50 מ"ל של מאגר קשירה (PBS המכיל 0.05% Tween-20, ו-0.1% אלבומין בסרום בקר (BSA)).
- שוקלים 50 מ"ג BSA על נייר שקילה ומעבירים לצינור חרוטי של 50 מ"ל. הוסף 50 מ"ל של PBS ולאחר מכן 25 μL של Tween-20 לצינור. מערבולת בעדינות כדי לערבב.
- הכן 50 מ"ל של מאגר חסימה (3% BSA ב- PBS).
- שוקלים 1.5 גרם BSA על נייר שקילה ומעבירים לצינור חרוטי של 50 מ"ל. מוסיפים 50 מ"ל של PBS, ומערבולת בעדינות כדי לערבב.
הערה: מומלץ לאחסן את כל המאגרים למשך שבוע עד שבוע אחד בטמפרטורה של 4 מעלות צלזיוס לקבלת התוצאות הטובות ביותר.
- שוקלים 1.5 גרם BSA על נייר שקילה ומעבירים לצינור חרוטי של 50 מ"ל. מוסיפים 50 מ"ל של PBS, ומערבולת בעדינות כדי לערבב.
2. אימוביליזציה של אנטיגן
- דיללו את האנטיגן במאגר האימוביליזציה כדי להגיע לריכוז של 5 מיקרוגרם/מ"ל.
- הוסף 100 μL לכל באר של אנטיגן לתחתית של 24 בארות של לוח 96 בארות, שטוח-תחתון, הניתן לשבירה במערך של 8 x 3 (עמודות 1-3 עבור שורות A-H). מכסים את הצלחת בנייר דבק.
הערה: ודא כי פני השטח של צלחת הבאר טופלו כדי למקסם את הספיחה של תחומים הידרופוביים והידרופיליים מעורבים. צלחות אלה שטופלו מראש זמינות באופן מסחרי. - אינקובציה בטמפרטורה של 4 מעלות צלזיוס ללילה.
- למחרת, לשטוף את הצלחת 3x עם חיץ כביסה.
- הופכים את הצלחת במהירות בכיור כדי להשליך את הנוזל ומקישים על הצלחת על ערימת מגבות נייר כדי להסיר את הנוזל העודף.
- באמצעות פיפטה רב-ערוצית, יש להוסיף 300 μL לכל באר של מאגר כביסה לבארות המכילות את האנטיגן. הסר את הנוזל כמתואר ב- 2.4.1. חזור על שלב הכביסה בסך הכל שלוש פעמים.
3. חסימת אתרים לא ספציפיים עם BSA
- באמצעות פיפטה רב-ערוצית, הוסיפו 300 μL לכל באר של מאגר חוסם ל-24 הבארות מצופות האנטיגן ו-24 בארות ריקות של לוחית 96 הבארות (עמודות 1-6 לשורות A-H).
- דגירה של הצלחת למשך שעה אחת בטמפרטורת הסביבה.
- שטפו את הצלחת עם 300 μL לכל באר של מאגר כביסה בסך הכל שלוש פעמים. עיין בשלב 2.4 לתיאור מפורט של שטיפת הצלחת.
4. דילולים סדרתיים והוספת תמיסת rAb
אזהרה: השלבים הבאים כוללים רדיואקטיביות. הצעדים צריכים להתבצע רק על ידי אלה עם הדרכת בטיחות קרינה. החוקרים צריכים להכפיל את הכפפה ולבצע צעדים עם סיכוך הולם.
- לסנתז את rAb תחת חקירה באמצעות שיטת הבחירה. ה-rAbs ששימשו כדוגמה סונתזו כפי שתואר קודם לכן19.
הערה: פרוטוקול זה מתמקד באפיון של rAb לאחר תיוג רדיו. - בצע דילולים טוריים של 8 x 3x (המיועדים לשורות A-H בלוח) של rAb במאגר הכריכה.
הערה: הריכוזים של הדילולים הסדרתיים ישתנו עבור כל rAb. הפרטים נדונים בסעיף הדיון. אם גורם הדילול משתנה, יש לחשב מחדש את הנפח הדרוש לכל דילול כדי להבטיח נפח מספיק עבור 1) קשירה של rAb בכל באר, 2) זריעת הדילול הבא, ו-3) ציטוט פתרון סטנדרטי rAb לספירת גמא כדי למדוד את הרדיואקטיביות של סך ה-rAb שנוסף לכל באר.- חשב את נפח ה-rAb הדרוש כדי ליצור תמיסה של 1.2 מ"ל של הריכוז הראשון (תווית כ-A).
- הוסף 800 μL של מאגר קשירה לצינורות microcentrifuge המסומנים B, C, D, ... ל-ח'. הוסף 1.2 מ"ל פחות הנפח המחושב בשלב 4.2.1 של מאגר קשירה לצינור microcentrifuge שכותרתו A.
- הוסף את נפח ה- rAb המלאי המחושב ב- 4.2.1 לצינור A. מערבולת בעדינות כדי לערבב ולאחר מכן להסתובב למטה באמצעות microcentrifuge מיני כדי לאסוף את כל הנוזלים בתחתית הצינור.
- הוסף 400 μL מצינור A לצינור B. מערבולת כדי לערבב ולאחר מכן להסתובב למטה באמצעות מיני microcentrifuge. חזור על הוספה מ - B ל - C, C ל - D, ..., G ל- H.
- הוסף 100 μL לכל באר של כל דילול לשלוש בארות משותקות עם אנטיגן ושלוש בארות חסומות עם BSA בלבד. לדוגמה, הוסף דילול A לבארות A1-A3 (אנטיגן) ו- A4-A6 (BSA).
- הוסף 100 μL של כל דילול לצינורות microcentrifuge המסומנים A std - H std. שמור צינורות אלה כתקני rAb שיש לבדוק במונה הגמא.
- דגירה של הצלחת למשך שעה אחת בטמפרטורה של 37 מעלות צלזיוס עם נדנדה עדינה.
5. לשטוף צלחות ולבחון רדיואקטיביות
- סימון צינורות microcentrifuge עבור כל באר (A1 עד A6, B1 עד B6 ... דרך H1-H6). השתמש בשני סמנים צבעוניים שונים כדי לקודד דגימות צבע אם תרצה - אחד עבור בארות מצופות אנטיגן ואחד עבור בארות עם BSA בלבד.
- שאפו את ה-rAb מכל באר באמצעות שאיפת ואקום.
- באמצעות פיפטה רב-ערוצית, הוסיפו 300 μL של מאגר כביסה לכל באר. שאפו את מאגר הכביסה. חזור על הכביסה בסך הכל חמש פעמים.
- מפרקים את הבארות לצינורות המיקרו-צנטריפוג' המתאימים.
- ספרו את הרדיואקטיביות בצינורות באמצעות מונה גמא. ספרו תחילה את הצינורות עם האנטיגן (H1, H2, H3 עד A1, A2, A3), ולאחר מכן את אלה עם BSA בלבד (H4, H5, H6 עד A4, A5, A6). כדי למזער את ההפרעות, ספרו בנפרד את התקנים עבור כל דילול (H std עד A std) בזמן אחר.
6. ניתוח נתונים
הערה: הקבצים המשלימים מכילים תבניות מתאימות של גיליון אלקטרוני וניתוח סטטיסטי לניתוח והתוויה של הנתונים.
- בגיליון אלקטרוני, חשב את האיגוד הכולל, הספציפי והלא ספציפי עבור כל דגימה (ראה את תבנית הגיליון האלקטרוני המצורפת כקובץ משלים).
- חשב "פעילות מאוגדת" כספירת לדקה (CPM) של המדגם (המתקבלת ממונה הגמא) חלקי CPM של התקן המתאים. חשב את "% מאוגד" כפעילות מאוגדת פעמים 100.
- חישוב "סה"כ מאוגד, מול/L" על ידי הכפלת "% מאוגד" בריכוז (mol/L) של rAb שנוסף. חשב "סה"כ מאוגד, מול" על ידי הכפלת "סה"כ מאוגד, מול/ל'" עם נפח rAb שנוסף בליטרים (0.0001 ליטר).
- חשב "איגוד ספציפי, מול" על ידי חיסור "סה"כ מאוגד, מול" של דילול BSA מתוך דילול האנטיגן כך ש- A1 מזדווג עם A4, A2 עם A5, A3 עם A6, B1 עם B4 וכו '.
- חשב "איגוד לא ספציפי, מול" על ידי חיסור "קשירה ספציפית, מול" מתוך "סך כל הכריכה, מול" עבור כל באר.
- בתוכנת האנליזה הסטטיסטית, שרטט את הריכוז של rAb שנוסף (nmol/L) על ציר x לעומת קשירה (מול) על ציר ה-y. צור קבוצות נפרדות כדי להתוות במשולש את הכריכה הכוללת, את הכריכה הספציפית ואת הכריכה הלא ספציפית. בצע ניתוח התאמה לא ליניארי על-ידי בחירת הפרמטרים הבאים בתוכנה שבה נעשה שימוש (טבלת חומרים; ראה את תבנית הניתוח הסטטיסטי המצורף כקובץ משלים).
- בחר ניתוח חדש. תחת ניתוחי XY, בחר רגרסיה לא ליניארית (התאמה עקומה). ודא שכל הנתונים נבחרים תחת נתח אילו ערכות נתונים? ולאחר מכן בחר אישור.
- בכרטיסיה מודל , תחת איגוד - רוויה, בחר אתר אחד - איגוד ספציפי. בכרטיסיה ביטחון עצמי , בחר זהה התאמות 'מעורפלות'. השאר את כל הפרמטרים האחרים כברירת מחדל ובחר אישור.
הערה: פעולה זו תחשב את KD ו- Bmax עבור הכריכה הכוללת, הספציפית והלא ספציפית. ה-KD של הכריכה הספציפית הוא KD ב-nmol/L של ה-rAb הקשור לאנטיגן.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
שיטה זו מחשבת זיקה מחייבת (KD) עבור rAb בהתבסס על מבחן איגוד הרוויה שבו נוספו ריכוזים שונים של rAb לכמות קבועה של אנטיגן משותק. עקומת הקשירה צריכה לעקוב אחר הצמיחה הלוגריתמית שבה היא תלולה בתחילה ואז רמה כאשר האנטיגן רווי. כדי להבטיח שה-KD שנקבע מדויק, הריכוזים של rAb חייבים להיות גבוהים מספיק כדי להגיע לרוויה. לצורך בדיקה זו, נוגדנים בעלי תווית רדיו הוצמדו ל- DFO ותויגו ב- 89Zr, כפי שתואר קודם לכן19. איור 3 מציג חלקות איגוד רוויה מייצגות. אמוואנטמאב בעל תווית רדיו-תאית, נוגדן דו-ספציפי לקולטן גורם גדילה אפידרמלי (EGFR) ולחלבון מעבר מזנכימלי-אפיתל ציטופלסמי (cMET), נקשר לחלבונים EGFR (איור 3A) ו-cMET (איור 3B). חלקות קשירה של רוויה מוצגות גם עבור ה-Fabs בעלי תווית הרדיו החד-זרועית הקשורה לחלבונים EGFR (איור 3C) ו-cMET (איור 3D)19. בכל תת-התת-תתי-תתי-תצפיות, עקומות רגרסיה לא ליניאריות ייצגו את סדרת הדילול עם חריגות מינימליות מהעקומות. כריכה ספציפית התאימה לרוב הכריכה הכוללת. בעוד שהקשירה הלא ספציפית הייתה נמוכה באופן כללי, ריכוזים גבוהים יותר של rAb הציגו קשירה לא ספציפית גדולה יותר, מה שמצביע על סף אפשרי לקשירה לא ספציפית במבחן זה. זיקות הקשירה של ה-rAbs היו בטווח הננו-מולארי הצפוי. ערכי KD של 8.4 ± 1.7 ננומטר ו- 4.2 ± 1.5 ננומטר עבור α-EGFR ו- α-cMET של זרוע אחת, בהתאמה, מדגימים זיקה דומה לאנטיגן המטרה כמו rAb הדו-ספציפי עם ערכי KD של 9.9 ± 2.1 ננומטר ו- 16.9 ± 5.9 ננומטר עבור EGFR ו- cMET, בהתאמה.
ניסויים תת-אופטימליים לקשירת α-cMET עם תווית רדיו לחלבונים משותקים של cMET מוצגים באיור 4 כדי להדגים את התוצאות של פרמטרים הדורשים אופטימיזציה. באיור 4A, טווח הריכוזים של rAb שנוסף היה נמוך מדי, והרוויה לא הושגה, כפי שמעידה עקומת הקשירה שלא הגיעה למישור. תנאים אלה הביאו לשרטוט ליניארי של ריכוז ה-rAb שנוסף לעומת rAb מאוגד. מכיוון שהנתונים אינם מתאימים למודל הרגרסיה הלא ליניארית, הערך KD נקבע כ"מעורפל" בניתוח הסטטיסטי. באיור 4B, נעשה שימוש בריכוזים גבוהים מדי עבור α-cMET עם תווית רדיו. הרוויה הושגה כפי שמצוין על ידי המישור האופקי של עקומת הכריכה. עם זאת, כריכה לא ספציפית תורמת באופן ניכר לסך הכריכה. תנאים אלה גורמים לכמות גבוהה של אי ודאות המסומנת על ידי ערך KD של 14.9 ננומטר עם רווח בר-סמך גדול של 95% של 4.8 - 44.2 ננומטר. לפיכך, אופטימיזציה של טווח הריכוזים של rAb שנוסף, כפי שמוצג באיור 3D, תספק ערכי KD מדויקים יותר. עקומת קשירת הרוויה מבוססת על משוואת מיכאליס-מנטן עבור קינטיקה של תגובה. עקומה מתאימה כאשר הנקודות מתפלגות באופן אקראי סביב קו הרגרסיה17. רווח בר-סמך צר מצביע על כך שהערך KD מדויק.

איור 3: חלקות איגוד רוויה כדי לקבוע KD. עקומות קשירה של [89Zr]Zr-DFO-amivantamab לחלבוני (A) EGFR ו-(B) cMET, (C) [89Zr]Zr-DFO-α-EGFR לחלבון EGFR, ו-(D) [89Zr]Zr-DFO-α-cMET לחלבונים cMET כדי לחשב זיקה מקשרת. פסי שגיאה מייצגים את סטיית התקן של נוגדן מסומן 89Zr עבור כל ריכוז. ממוצע ± SD של KD ו-Bmax מוצגים משלושה ניסויים בלתי תלויים עבור כל מצב. נעשה שימוש חוזר בנתון זה באישור Cavaliere et al19. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
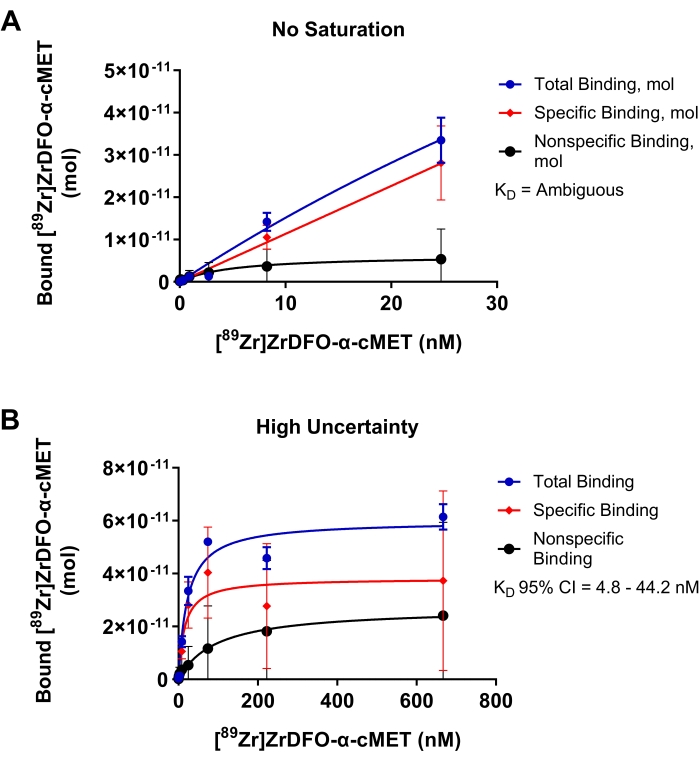
איור 4: חלקות איגוד רוויה שבהן לא ניתן לקבוע במדויק את KD . קשירת [89Zr]Zr-DFO-α-cMET לחלבונים cMET. פסי שגיאה מייצגים את סטיית התקן של גבול [89Zr]Zr-DFO-α-cMET. (A) ריכוזים של [89Zr]Zr-DFO-α-cMET נמוכים מדי ואין להגיע לרוויה. לא ניתן לחשב את KD מכיוון שהעקומה היא ליניארית ואינה מתאימה למודל הרגרסיה הלא ליניארית. (B) אי-ודאות גבוהה עבור הכריכה הספציפית מסומנת על-ידי הרווח בר-סמך רחב של 95% (CI) עבור KD (4.8-44.2 ננומטר). יש גם קשירה לא ספציפית גבוהה עקב ריכוזים גבוהים של rAb. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
קבצים משלימים. אנא לחץ כאן כדי להוריד קובץ זה.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
כחלק מהפיתוח של rAbs, חשוב לוודא ש-rAb נקשר באופן ספציפי למטרה שלו עם זיקה מחייבת גבוהה. קביעת זיקה מחייבת יכולה ליידע אם האימונו-פעילות החיסונית של ה-rAb מושפעת משילוב רדיו באמצעות בדיקת הרדיוליגנד והרוויה באמצעות אנטיגן משותק. קביעת איגוד rAb ל- BSA יכולה לשמש לכימות קשירה לא ספציפית כדי למדוד קשירה ספציפית לאנטיגן המשותק בצורה מדויקת יותר. שיטה זו בודקת את האיגוד של ריכוזים שונים של rAb כדי ליצור עקומת קשירה רוויה כדי לחשב את KD ולקבוע זיקה מחייבת.
כדי לבצע בדיקה זו, יש צורך באנטיגן של ה- rAb תחת חקירה. האנטיגן צריך להיות בעל האפיטופ שאליו נקשר הנוגדן. במצבים שבהם לנוגדנים חדשים יש אפיטופים מחייבים לא ידועים, שיטות שאינן מתויגות רדיו לקביעת זיקה מקשרת עשויות להיות מתאימות יותר. לפני תחילת הניסוי, מומלץ לחפש ספרות. אנטיגנים בעלי עניין ששימשו בעבר במבחנים מבוססי ELISA צפויים להיות יעילים לבדיקה זו.
בהתאם לזמן מחצית החיים של הרדיונוקליד ולרגישות של מונה הגמא, ייתכן שייקח זמן עד שהסטנדרטים יתפוררו לרמה של רדיואקטיביות שנמצאת בגבולות הכמותיים של מונה הגמא. אם רמת הרדיואקטיביות צפויה להיות גבוהה מדי עבור מונה הגמא, דיללו את הדגימות הסטנדרטיות ולאחר מכן הכפילו את גורם הדילול בניתוח הנתונים. צעד זה צריך להיעשות ביום הניסוי כדי למנוע את האפשרות של צבירה נוגדנים או השפלה שעלולה לגרום לפתרונות סטנדרטיים לא הומוגניים וקריאה לא מדויקת.
יצירת עקומת רוויה בעלת צורה מתאימה מבוססת על סדרת הדילול שנבחרה. תהליך זה ידרוש ניסוי וטעייה. חוסר היכולת להכליל את הריכוזים של rAbs הוא מגבלה של הפרוטוקול, שכן כל rAbs צפויים להיות בעלי זיקות מחייבות שונות עבור האנטיגנים שלהם. פרוטוקול זה צריך להיות מותאם עבור כל rAb. לאחר האופטימיזציה, הפרוטוקול צריך להיות ניתן לשחזור עבור rAb הספציפי. ייתכן שיהיה צורך להתאים הן את טווח הריכוז והן את גורם הדילול בהתאם לצורת העקומה. בהינתן הטווח הננו-מולארי הצפוי לקשירת נוגדנים, החל מהייצוג הרחב ביותר האפשרי של טווח זה יאפשר להתקרב לטווח ריכוז צר יותר של עניין לניסויים עתידיים. במקום שמונה דילולים סדרתיים, שש עשרה יספקו יותר נקודות נתונים כדי להבין את טווח הכריכה. אם ידוע על KD של הנוגדן הלא-מחובר, מומלץ להשתמש בערך זה כריכוז אמצעי של הטווח בעת תכנון המחקר לראשונה. בהתאם לזמינות החומרים, ניסויים מתמשכים מרובים עם טווחי ריכוז וגורמי דילול שונים יכולים לייעל את הפרוטוקול מהר יחסית. ניתן להתאים את זמן הדגירה כדי להבטיח הגעה לרוויה. בנוסף, אם הכריכה נמוכה אפילו ברוויה, ייתכן שאין מספיק טווח אות כדי לחשב במדויק את KD. ייתכן שיהיה צורך באופטימיזציה של ריכוז האנטיגן המשותק. מחקר ראשוני עשוי להתבצע עם ריכוזים שונים של אנטיגן משותק וריכוז המלאי של rAb כדי לקבוע את אות הקישור המרבי.
בדיקת רוויית רדיוליגנד היא שיטה מבוססת ויש לה יתרונות רבים, בהשוואה לשיטות אחרות שאינן מתויגות ברדיו-תווית כגון ציטומטריית זרימה או תהודה פלסמונית משטחית (SPR), לקביעת זיקת הקישור של rAbs. שיטות המשתמשות באיתור נוגדנים שאינם בעלי תווית רדיו קובעות את הזיקה המחייבת של דגימה מעורבת המורכבת הן מהנוגדנים המצומדים והן מהנוגדנים הלא מחוברים. בבדיקת רוויית רדיוליגנד ורוויה, האות היחיד שנרשם הוא זה של צמד הנוגדנים בעלי התווית הרדיולית, המספק KD מדויק יותר עבור המינים בעלי התוויות הרדיוליות שישפיעו על היישום הביו-רפואי. שיקול זה הופך את התוצאות מבדיקת רוויית רדיוליגנד ואלה מטכניקות שאינן מתויגות באופן כמעט בלתי ניתן להשוואה מכיוון שהן מודדות דגימות שונות - rAb לעומת rAb בתוספת נוגדן הורי. מחקר אחד השווה את הזיקה המחייבת של צמד נוגדנים-כלטור ללא תווית רדיולית לבין הנוגדן הדו-ספציפי ההורי המשתמש ב-SPR על חלבונים משותקים. היה הבדל של פי חמישה בין ערכי ה-KD של צמד הנוגדנים-כלאטור לבין הנוגדן ההורי. ההבדל בערכי KD שנמצאו בין SPR למבחן רוויה בקווי תאים מרובים נע בין פי 10 ל-1,00023. כלאטור הנוגדנים שאינם בעלי תווית רדיו הוא תערובת של נוגדנים מצומדים ולא מחוברים, בעוד שערכי KD הנקבעים על ידי בדיקת הרוויה הם רק מהנוגדן המצומד בעל התווית הרדיולית. קיימת גם שונות בביטוי האנטיגן בין קווי התאים שבהם נעשה שימוש. לפיכך, לא ניתן להשתמש בטכניקות שאינן מתויגות ברדיו כדי לאמת את בדיקת הרוויה של הרדיוליגנד. עם זאת, לאחר שנקבע ה- KD של ה- rAb, ניתן לבצע בדיקת קשירה תחרותית כדי לקבוע הבדלים בקשירת קשר בין ההורה לבין הווריאנטים המצומדים של הנוגדן17,21.
ניתן להרחיב את בדיקת הרוויה הרדיוליגנד כדי לקבוע את קשירת הרוויה של ה-rAb לתאים ולא את האנטיגן המשותק. באמצעות אותם מושגים, ניתן להוסיף ריכוזים שונים של rAb למספר קבוע של תאים. לאחר מכן ניתן להשתמש בניתוח הנתונים המתואר בפרוטוקול כדי לקבוע את הזיקה המחייבת של rAb לתאים, מה שיקבע גם את Bmax כדי לחשב את מספר מולקולות האנטיגן הקיימות בקו העניין של התאים. ניתן גם להכליל שיטה זו לפיגומים אחרים של חלבונים ופפטידים בעלי תווית רדיולית כדי לקבוע את הקשר הספציפי שלהם למטרותיהם. לסיכום, פרוטוקול זה מתאר את תהליך קביעת הזיקה המחייבת של rAbs לאנטיגנים חלבוניים משותקים. התהליך משתמש בטכניקות מעבדה בסיסיות כדי ליצור דילולים סדרתיים של rAb כדי להוסיף לאנטיגן המשותק. ההיבט המאתגר ביותר הוא לקבוע את הריכוזים של rAb כדי ליצור עקומת קשירה רוויה מעוצבת כראוי. תהליך זה דורש ניסוי וטעייה בפיתוח הבדיקה עבור rAbs בודדים, אך לאחר מכן ניתן יהיה לשחזר אותו לאחר שנקבע. ה- KD המחושב יכול לשמש כמדד של פעילות חיסונית כקריטריון להתקדמות עם יישומי הדמיה או טיפול, או כדי לחדד את תגובת ההצמדה של נוגדנים-כלאט.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
למחברים אין ניגודי עניינים.
Acknowledgments
המחברים מודים ל-3D Imaging על הייצור של [89Zr]Zr-oxalate ולד"ר שרי מורס מחברת Janssen Pharmaceuticals על אספקת נוגדנים.
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P. Radioligand binding assays and their analysis. in Receptor Binding Techniques. Davenport, A. P. , Humana Press. 31-77 (2012).
- Davenport, A. P., Russell, F. D. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. Mather, S. J. , Springer. Netherlands. 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).



