Summary
ここでは、固定化抗原に対する放射性標識抗体の結合親和性(KD)を決定する方法について説明する。KD は、その抗原に対する様々な濃度での放射性標識抗体の全体的、特異的、および非特異的結合を測定することによって飽和結合実験から決定することができる平衡解離定数である。
Abstract
結合親和性(KD)の決定は、放射性標識抗体(rAb)の特性評価の重要な側面である。典型的には、結合親和性は平衡解離定数KDによって表され、抗体結合部位の半分が平衡で占有される抗体の濃度として計算することができる。この方法は、任意の放射標識抗体または他のタンパク質およびペプチドスカフォールドに一般化することができる。細胞ベースの方法とは対照的に、固定化抗原の選択は、抗体の長期保存後の結合親和性を検証し、二重特異性抗体構築物におけるフラグメント抗原結合領域(Fab)アームの結合親和性を区別し、異なる細胞株間で抗原発現にばらつきがあるかどうかを決定するために特に有用である。この方法は、破砕可能な96ウェルプレート上の指定されたウェルに一定量の抗原を固定化することを含む。次いで、非特異的結合を、ウシ血清アルブミン(BSA)を用いて全てのウェルにおいてブロッキングした。続いて、rAbを全てのウェルに濃度勾配で添加した。rAbが飽和に達することを可能にするために、すなわち、すべての抗原がrAbによって連続的に結合される抗体の濃度の範囲が選択された。抗原を固定化していない指定ウェルにおいて、rAbの非特異的結合が決定され得る。抗原を固定化したウェル内の総結合から非特異的結合を差し引くことにより、抗原に対するrAbの特異的結合を決定することができる。rAbの KDを、得られた飽和結合曲線から算出した。一例として、結合親和性は、上皮成長因子受容体(EGFR)および細胞質間葉系上皮転移(cMET)タンパク質に対する二重特異性抗体である放射性標識アミバンタマブを用いて決定した。
Introduction
放射性標識抗体(rAb)は、医学において様々な用途を有する。その大半は腫瘍学においてイメージングおよび治療薬として利用されているが、リウマチ関連炎症、心臓病学、および神経学のためのイメージング用途がある1。イメージングrAbsは、病変を検出するために高感度を有し、治療のための患者の選択を支援する可能性を秘めている2,3,4,5。それらはまた、それぞれの抗原に対する特異性のために治療に使用される。セラノスティックスとして知られる戦略では、同じrAbが画像化と治療の両方に使用されます6。
理想的には、放射性標識のために選択された抗体は、非放射性標識法を用いて高い結合親和性および特異性を有することが既に証明されているものである。抗体の放射性標識は、安定な共有結合を形成する放射性核種(例えば放射性ヨウ素)による抗体の直接化学修飾によって、またはその後放射性金属に配位するキレート剤とのコンジュゲーションを介して間接的に達成することができる7,8。放射性ヨウ素による直接放射性標識は、抗体上のチロシンおよびヒスチジン残基を特異的に修飾する。これらの残基が抗原結合にとって重要である場合、この放射性共役は結合親和性を変化させるであろう。逆に、抗体のコンジュゲーションおよび間接放射性標識のための複数の確立されたプロトコルがある。例えば、抗体のPETイメージングのためにジルコニウム−89(89Zr)を結合するために使用される一般的なキレート剤は、抗体9,10のリジン残基にランダムに結合されるp−イソチオシアナトベンジル−デスフェリオキサミン(DFO)である。抗原結合領域にリジン残基がある場合、これらの部位でのコンジュゲーションは立体的に抗原結合を妨げ、したがって抗体 - 抗原結合を損なう可能性がある。したがって、抗体の間接的または直接的な放射性標識に使用される異なる放射性コンジュゲーション法は、抗体放射性結合体がその抗原に結合する能力として定義される免疫反応性に潜在的に影響を及ぼし得る7、11。部位特異的コンジュゲーション法はこの制限を回避することができるが、これらの技術は、追加のシステイン残基または炭水化物残基に対する酵素反応における専門知識を組み込むために抗体工学を必要とする12、13、14、15、16。抗体が放射性標識されたら、rAbの特性評価の一環として免疫反応性が保持されているかどうかを試験することが重要です。免疫反応性を測定する1つの方法は、rAbの結合親和性を決定することである。
このプロトコールの目的は、rAb−抗原結合を定量するために確立された放射性リガンド飽和アッセイを用いてrAbsに対する結合親和性を決定するためのプロセスを記述することである。バインドの傾向の概要を図 1 に示します。結合する抗原の量は、固定化された抗原の一定量により多くのrAbが添加されるにつれて増加するであろう。すべての抗原結合部位が飽和すると、プラトーに達し、さらにrAbsを追加しても、結合した抗原の量には影響しません。このモデルにおいて、平衡解離定数(KD)は、抗原受容体17の半分を占める抗体の濃度である。KDは、抗体がその標的にどの程度よく結合するかを表し、より高い結合親和性に対応するより低いKDを有する。理想的なrAbは、1ナノモル以下の18のKDを有するべきであることが以前に報告された。しかしながら、より最近のrAbsは、低ナノモル範囲のKDを用いて開発されており、非侵襲的画像化用途に適していると考えられている19、20、21、22。rAbsの放射性リガンド飽和アッセイにおいて決定され得る別のパラメータは、抗原結合の最大量に対応するBmaxである。Bmaxは、必要に応じて抗原分子の数を計算するために使用することができる。

図1:代表的な飽和結合曲線。 結合した抗原の割合を、一定量の抗原に添加する抗体の濃度の増加に対してプロットする。ポップアウトは、さまざまなポイントでバインドを示します。KD およびBmaxに対応する濃度および結合を、それぞれ、示す。この図は BioRender.com で作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
このアッセイは、放射標識二重特異性抗体構築物が、それらのそれぞれの抗原と結合する放射性標識二重特異性抗体の各断片抗原結合領域(Fab)アームについての KDを決定するために特に重要である。このプロトコルを使用して、固定化抗原上の各FabアームのKDを別々に決定し、それぞれの抗原に対する各Fabアームの結合 親和性が放射コンジュゲーション後に影響を受けたかどうかを独立して特徴付けることができる。このプロトコールは、上皮成長因子受容体(EGFR)および細胞質間葉上皮転移(cMET)タンパク質に対する二重特異性抗体である放射標識アミバンタマブの使用によって実証される19。一方のFabアームがEGFR(α-EGFR)またはcMET(α-cMET)に結合し、もう1つのFabアームがアイソタイプコントロールである放射性標識シングルアーム抗体も、実施例19として使用した。このプロトコールは、固定化され得る既知の抗原を有する任意の放射性標識抗体にも適している。このプロトコールでは、rAbの希釈系列を、rAbの各Fabアームに特異的な指定されたウェル内の固定化抗原の一定量に添加する。rAbはまた、抗原を含まないウシ血清アルブミン(BSA)のみでブロックされたウェルに添加され、非特異的結合を決定する。特異的結合を決定するために、固定化抗原に対する非特異的結合は、総rAb結合から差し引かれる。得られた飽和結合曲線は、次いで、上述のようにKDを決定するために使用される。
この方法の利点の1つは、細胞培養中に抗原発現レベルが影響を受ける可能性があり、異なる細胞株が可変レベルの抗原発現を有することを考えると、精製抗原を抗原の供給源として使用する場合と比較して、より高い再現性である。放射性標識二重特異性抗体の場合、一方の抗原のみを発現し、他方を発現しない細胞株は入手できない可能性があり、個々のFabアームの結合親和性を特徴付けることを非常に困難にする。特に、非放射性標識法に対する放射性リガンド飽和アッセイ法の主な利点は、rAbの非共役画分の寄与なしにrAbの結合親和性の特異的特徴付けである。著者らの知る限りでは、rAbをその親非コンジュゲート抗体から分離する精製技術は現在存在しない。キレート剤および放射性核種の比較的小さいサイズを考えると、rAbの全体的な分子量に対するそれらの寄与は、サイズ排除クロマトグラフィーにおいて重要ではない。したがって、任意の放射性標識技術から生成された生成物は、ほとんどの場合、rAbとその親非コンジュゲート抗体との混合物である。放射性標識飽和アッセイを使用して結合親和性を特徴付けることで、試験される生成物が単にrAbであることを保証します。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
メモ: プロトコルのグラフィカルな表現については、 図 2 を参照してください。

図2:プロトコルの概略図行ラベルと列ラベルは、壊れやすい96ウェルプレートを設定するためのガイドとして示されています。予想される結合は、抗原およびBSAについてのよくある例に示されている。湾曲した矢印は、BSAのみで井戸から洗い流されることが期待されるrAbを示します。この図は BioRender.com で作成されました。この図の拡大版を表示するには、ここをクリックしてください。
1. バッファー調製
- 50 mLの固定化緩衝液(50 mMNa2CO3の水溶液;pH=9.0)を調製する。
- 計量紙に191mgのNaHCO3および23.9mgのNa2CO3を計量し、50mLの円錐管に移す。40mLの18MΩの水と渦を加えて溶解させる。必要に応じてpHを9.0に調整してから、18MΩの水で総容量を50mLにします。
- 200 mL の PBS と 100 μL の Tween-20 を 250 mL のボトルに添加して、約 200 mL の洗浄バッファー (0.05% Tween-20 を含むリン酸緩衝生理食塩水 (PBS) を調製します。
- 50 mLの結合緩衝液(0.05%Tween-20、および0.1%ウシ血清アルブミン(BSA)を含むPBS)を調製する。
- 秤量紙に50mgのBSAを計量し、50mLの円錐管に移す。50 mL の PBS と 25 μL の Tween-20 をチューブに加えます。渦を優しく混ぜる。
- 50 mLのブロッキングバッファー(PBS中の3% BSA)を調製する。
- 計量紙に1.5 gのBSAの重さを量り、50 mLの円錐形チューブに移します。50mLのPBSを加え、穏やかに渦を巻いて混合する。
注: 最良の結果を得るために、すべてのバッファーを 4 °C で最大 1 週間保存することをお勧めします。
- 計量紙に1.5 gのBSAの重さを量り、50 mLの円錐形チューブに移します。50mLのPBSを加え、穏やかに渦を巻いて混合する。
2. 抗原固定化
- 抗原を固定化バッファーで希釈し、5 μg/mL の濃度にします。
- 8 x 3アレイの壊れやすい96ウェルの平底プレートの24ウェルの底に抗原1ウェルあたり100 μLを加えます(A-H行の場合は列1~3)。プレートをシーリングテープで覆います。
注:ウェルプレートの表面が、混合疎水性ドメインと親水性ドメインの吸着を最大化するように処理されていることを確認してください。これらの前処理プレートは市販されている。 - 4°Cで一晩インキュベートする。
- 翌日、プレート3xを洗浄バッファーで洗浄する。
- 流し台でプレートを勢いよくひっくり返して液体を処分し、ペーパータオルの山の上でプレートをタップして余分な液体を取り除きます。
- 多チャンネルピペットを用いて、抗原を含むウェルに洗浄バッファーを1ウェルあたり300 μL加える。2.4.1 の説明に従って液体を取り出します。洗浄工程を合計3回繰り返す。
3. BSAによる非特定サイトのブロック
- マルチチャンネルピペットを使用して、96ウェルプレートの24個の抗原コーティングウェルおよび24個の空ウェル(A-H行の列1~6)にブロッキングバッファーを1ウェルあたり300 μL加えます。
- プレートを周囲温度で1時間インキュベートする。
- プレートを1ウェルあたり300 μLの洗浄バッファーで合計3回洗浄します。プレートの洗浄の詳細な説明については、ステップ 2.4 を参照してください。
4. rAb溶液の段階希釈および添加
警告: 次の手順は放射能を伴います。手順は、放射線安全訓練を受けた人のみが行うべきです。研究者は手袋を二重にし、適切なシールドで手順を実行する必要があります。
- 選択した方法を使用して、調査中のrAbを合成します。例として用いたrAbsを、先に説明したように合成した19。
注: このプロトコルは、一度無線ラベル付けされた rAb の特性評価に焦点を当てています。 - 結合バッファー中の rAb の 8 x 3 倍の段階希釈 (プレート上の行 A-H に指定) を作成します。
注:段階希釈液の濃度は、rAbごとに異なります。詳細については、「ディスカッション」セクションで説明します。希釈係数が変化した場合、各希釈に必要な体積を再計算して、1)各ウェルにおけるrAbの結合、2)以下の希釈液の播種、および3)ガンマ計数用のrAb標準溶液を分注して、各ウェルに添加された総rAbの放射能を測定するのに十分な体積を確保する必要があります。- 最初の濃度の1.2mL溶液( Aとしてラベル)を作るために必要なストックrAbの量を計算します。
- 800 μLの結合バッファーをB、C、D、...Hに。結合緩衝液のステップ4.2.1で計算した容量を引いた1.2mLを標識Aの微量遠心管に加える。
- 4.2.1で計算したストックrAbの体積をチューブ Aに追加します。渦を穏やかに混合してから、ミニ微量遠心分離機を使用してスピンダウンし、チューブの底にあるすべての液体を収集します。
- チューブAからチューブBに400 μLを加える。渦を混ぜ合わせ、ミニ微量遠心分離機を使用してスピンダウンします。B から C、C から D、...、G から H への加算を繰り返します。
- 各希釈液のウェルあたり100 μLを抗原で固定化した3つのウェルおよびBSAのみでブロックした3つのウェルに加える。例えば 、希釈A をA1-A3(抗原)およびA4-A6(BSA)のウェルに加える。
- 各希釈液の100 μLを 、A std-H stdと標識した微量遠心チューブに加える。これらのチューブをrAb標準として保存し、ガンマカウンターでアッセイします。
- プレートを穏やかな揺れで37°Cで1時間インキュベートする。
5. プレートを洗浄し、放射能を測定する
- 各ウェルの微量遠心チューブにラベルを付けます(A1〜A6、B1〜B6...H1-H6)を介して)。必要に応じて、サンプルを色分けするために 2 つの異なる色のマーカーを使用します (1 つは抗原でコーティングされたウェル用、もう 1 つは BSA のみのウェル用)。
- 真空吸引器を使用して各ウェルからrAbを吸引する。
- マルチチャンネルピペットを使用して、各ウェルに300 μLの洗浄バッファーを追加します。洗浄バッファーを吸引します。洗浄を合計5回繰り返す。
- ウェルを適切な微量遠心チューブに分解します。
- ガンマカウンターを使用してチューブ内の放射能をカウントします。最初に抗原を含むチューブ(H1、H2、H3からA1、A2、A3)を数え、次にBSAのみを含むチューブ(H4、H5、H6からA4、A5、A6)を数えます。干渉を最小限に抑えるには、希釈(H std から A std)ごとに異なる時間に標準を個別にカウントします。
6. データ解析
メモ: 補足ファイルには、データを分析およびプロットするための対応するスプレッドシートおよび統計分析テンプレートが含まれています。
- スプレッドシートで、各サンプルの合計、特定、および非特異的結合を計算します (補足ファイルとして添付されたスプレッドシート テンプレートを参照)。
- 「結合活性」は、サンプル(ガンマカウンターから得られた)の1分あたりのカウント数(CPM)を適切な標準のCPMで割った値として計算します。「% bound」を [バインドされたアクティビティ] × 100 として計算します。
- 「%結合」に添加したrAbの濃度(mol/L)を乗じて、「総結合、mol/L」を計算します。「総結合、mol/L」にリットル単位で添加されたrAbの量(0.0001 L)を掛けて、「総結合、モル」を計算します。
- A1がA4と対になるように抗原希釈液からBSA希釈液の「総結合量、mol」を差し引いて「特異的結合、mol」を計算し、A2とA5、A3とA6、B1とB4などを対にします。
- 各ウェルの「総結合量、mol」から「特異的結合、mol」を差し引くことによって、「非特異的結合、mol」を計算する。
- 統計解析プロットソフトウェアでは、x軸に添加されたrAbの濃度(nmol/L)とy軸の結合(mol)をプロットします。別々のグループを作成して、合計結合、特定結合、非特異的結合の3連でプロットします。使用するソフトウェアで次のパラメータを選択して、非線形適合分析を実行します(材料表、補足ファイルとして添付されている統計解析テンプレートを参照)。
- [ 新しい分析] を選択します。 XY 分析で、 非線形回帰 (カーブフィット) を選択します。[ どのデータ セットを分析 ] ですべてのデータが選択されていることを確認し、[ OK] を選択します。
- [ モデル ] タブの [ バインド - 彩度] で、[ 1 つのサイト - 特定のバインド] を選択します。[ 信頼度 ] タブで、[ あいまいな" 適合値を特定する] を選択します。他のすべてのパラメーターをデフォルトのままにして、[ OK] を選択します。
注: これにより、合計結合、固有結合、および非特異的結合の KD および Bmax が計算されます。特異的結合のKDは、抗原に結合したrAbのnmol/L単位のKDである。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
この方法は、異なる濃度のrAbを固定化抗原に添加した飽和結合アッセイに基づいて、rAbに対する結合親和性(KD)を計算する。結合曲線は、最初は急勾配で、抗原が飽和するにつれてプラトーになる対数成長に従うべきである。決定されたKD が正確であることを保証するために、rAbの濃度は飽和に達するのに十分高くなければならない。このアッセイのために、放射性標識抗体をDFOにコンジュゲートし、前述のように 89Zrで放射性標識した19。 図3は 、代表的な飽和結合プロットを示す。放射性標識アミバンタマブは、上皮成長因子受容体(EGFR)および細胞質間葉上皮転移(cMET)タンパク質に対する二重特異性抗体であり、EGFR(図3A)およびcMETタンパク質(図3B)に結合した19。EGFR(図3C)およびcMET(図3D)タンパク質に結合したシングルアーム放射性標識Fabについての飽和結合プロットも示されている19。すべてのサブ図において、非線形回帰曲線は、曲線からの外れ値が最小の希釈系列を表していた。特異的結合は、全結合の大部分に対応していた。非特異的結合は全体的に低かったが、より高い濃度のrAbはより大きな非特異的結合を示し、このアッセイにおける非特異的結合の可能性のある閾値を示した。rAbsの結合親和性は、予想されるナノモル範囲にあった。シングルアーム±-EGFRおよび±-cMETのKD 値はそれぞれ8.4 α 1.7 nMおよび4.2 α 1.5 nMであり、EGFRおよびcMETについてそれぞれ9.9 ± 2.1 nMおよび16.9 ± 5.9 nMのKD 値を有する二重特異性rAbと同様の親和性を示す。
固定化cMETタンパク質への放射性標識α-cMETの結合に関する最適でない実験を 図4 に示し、最適化を必要とするパラメータの結果を実証する。 図4Aでは、添加したrAbの濃度範囲が低すぎ、結合曲線が示すように飽和に達しておらず、プラトーに達していなかった。これらの条件は、結合したrAbに対する添加されたrAbの濃度の線形プロットをもたらした。データは非線形回帰モデルに適合しないため、統計解析においてKD 値は「曖昧」であると判定された。 図4Bでは、高すぎる濃度が放射性標識α-cMETに使用された。結合曲線の水平プラトーによって示されるように飽和に達した。しかしながら、非特異的結合は、総結合に顕著に寄与する。これらの条件は、4.8 ~44.2nMの大きな95%信頼区間を有する14.9nMのKD値によって示される高い量の不確実性をもたらす。したがって、 図3Dに示すように、添加されるrAbの濃度範囲を最適化すると、より正確なKD値が提供されます 。飽和結合曲線は、反応速度論のミカエリス・メンテン方程式に基づいている。曲線は、点が回帰直線17の周囲にランダムに分布している場合に良好に適合する。信頼区間が狭い場合は、KD 値が 正確であることを示します。

図3:KDを決定するための飽和結合プロット。[89Zr]Zr-DFO-アミバンタマブの(A)EGFRおよび(B)cMETタンパク質への結合曲線、(C)[89Zr]Zr-DFO-α-EGFRタンパク質、および(D)[89Zr]Zr-DFO-α-cMETのcMETタンパク質への結合親和性を計算した。エラーバーは、各濃度について結合した89個のZr標識抗体の標準偏差を表す。KDおよびBmaxの平均±SDは、各条件について3つの独立した実験から示されている。この図は、Cavaliere et al19の許可を得て再利用されている。この図の拡大版を表示するには、ここをクリックしてください。
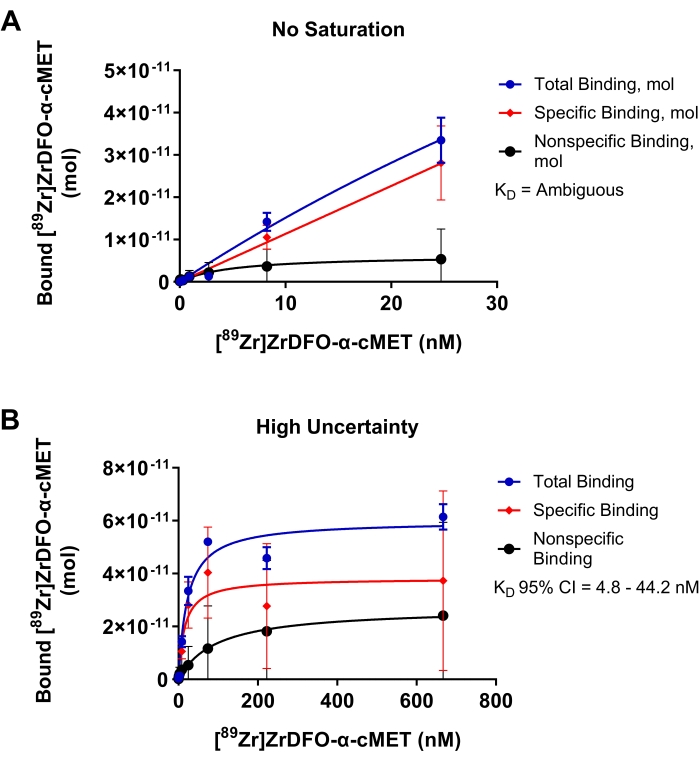
図4:KDを正確に決定できない飽和結合プロット。 cMETタンパク質への[89Zr]Zr-DFO-α-cMETの結合。エラーバーは、結合[89Zr]Zr-DFO-α-cMETの標準偏差を表す。(A)[89Zr]Zr-DFO-α-cMETの濃度が低すぎて飽和に達していない。KD は、曲線が線形であり、非線形回帰モデルに適合しないため、計算できません。(b)特異的結合についての高い不確実性は、KD(4.8〜44.2nM)についての広い95%信頼区間(CI)によって示される。高濃度のrAbによる高い非特異的結合もある。この図の拡大版を表示するには、ここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
rAbsの開発の一環として、rAbが高い結合親和性でその標的に特異的に結合することを確実にすることが重要です。結合親和性を決定することは、rAbの免疫反応性が、固定化抗原を用いた放射性リガンド飽和アッセイを介して放射性コンジュゲーションによって影響を受けるかどうかを知らせることができる。BSAへのrAb結合の決定は、非特異的結合を定量するために使用して、固定化抗原への特異的結合をより正確に測定することができる。この方法は、異なる濃度のrAbの結合を試験して飽和結合曲線を生成し、KDを計算し、結合 親和性を決定する。
このアッセイを行うには、調査中のrAbの抗原を持っていなければならない。抗原は、抗体が結合するエピトープを有する必要がある。新規抗体が未知の結合エピトープを有する状況では、結合親和性を決定する非放射性標識法がより適切であり得る。実験を開始する前に、文献検索をお勧めします。ELISAベースのアッセイで以前に使用されていた目的の抗原は、このアッセイに有効である可能性が高い。
放射性核種の半減期とガンマカウンターの感度によっては、標準物質がガンマカウンターの量的限界内にある放射能レベルまで減衰するまでに時間がかかることがあります。放射能レベルがガンマカウンターに対して高すぎると予想される場合は、標準サンプルを希釈してから、データ分析で希釈係数を掛けます。このステップは、不均一な標準溶液および不正確な読み取りをもたらす可能性のある抗体凝集または分解の可能性を避けるために、実験当日に行うべきである。
適切な形状の飽和曲線を生成することは、選択した希釈系列に基づいています。このプロセスには試行錯誤が必要です。rAbsの濃度を一般化できないことは、すべてのrAbsが抗原に対して異なる結合親和性を有することが予想されるため、プロトコルの制限である。このプロトコルは、rAb ごとに最適化する必要があります。最適化されると、プロトコルは特定のrAbに対して再現可能である必要があります。濃度と希釈係数の両方の範囲は、曲線の形状に基づいて調整する必要があるかもしれません。抗体結合に予想されるナノモル範囲を考えると、この範囲を可能な限り広く表現することから始めると、将来の試験のために関心のあるより狭い濃度範囲を拡大することができます。8 つの段階希釈の代わりに、16 個の連続希釈が、結合の範囲を理解するためにより多くのデータ ポイントを提供します。非コンジュゲート抗体の KDが既知である場合、最初に研究を設計する際に、その値を範囲の中間濃度として使用することが推奨される。材料の入手可能性に応じて、異なる濃度範囲および希釈因子を有する複数の進行中の試験を有することは、プロトコールを比較的迅速に最適化することができる。インキュベーション時間は、飽和に達するように調整されてもよい。さらに、飽和状態でも結合が低い場合、KDを正確に計算するのに十分な信号範囲がない可能性があります。固定化抗原の濃度を最適化することが必要な場合があります。最大結合シグナルを決定するために、異なる濃度の固定化抗原およびrAbのストック濃度を用いて予備的研究を行うことができる。
放射性リガンド飽和アッセイは確立された方法であり、フローサイトメトリーや表面プラズモン共鳴(SPR)などの他の非放射性標識法と比較して、rAbsの結合親和性を決定するための多くの利点を有する。非放射性標識抗体の検出を採用する方法は、コンジュゲート抗体と非コンジュゲート抗体の両方からなる混合サンプルの結合親和性を決定する。放射性リガンド飽和アッセイにおいて、登録される唯一のシグナルは放射性標識抗体複合体のシグナルであり、これは生物医学的応用に影響を与える放射性標識種に対してより正確なKDを提供する。この検討により、放射性リガンド飽和アッセイの結果と非放射性標識技術の結果は、異なるサンプル(rAb vs. rAb + 親抗体)を測定するため、実質的に比類のないものになります。ある研究では、固定化タンパク質に対するSPRを用いた非放射性標識抗体キレート剤コンジュゲートと親二重特異性抗体の結合親和性を比較した。抗体キレート剤コンジュゲートと親抗体のKD値との間には5倍の差があった。SPRと複数の細胞株の飽和アッセイとの間に見出されたKD値の差は、10倍から1,000倍から23倍の範囲であった。非放射性標識抗体キレート剤は、コンジュゲート抗体と非コンジュゲート抗体の混合物であり、飽和アッセイによって決定されるKD値は、放射性標識コンジュゲート抗体からのみである。使用される細胞株間で抗原発現にばらつきもある。したがって、非放射性標識技術は、放射性リガンド飽和アッセイを検証するために使用することができない。しかしながら、rAbのKDが決定されたら、抗体17、21の親体および結合変異体との間の結合の違いを決定するために競合結合アッセイを実施してもよい。
放射性リガンド飽和アッセイを延長して、固定化抗原ではなく細胞へのrAbの飽和結合を決定することができる。同じ概念を使用して、異なる濃度のrAbを固定数の細胞に添加することができる。次に、プロトコールに概説されているデータ解析を使用して、細胞に対するrAbの結合親和性を決定することができ、Bmax も決定して、目的の細胞株上に存在する抗原分子の数を計算することができる。この方法はまた、他の放射性標識タンパク質およびペプチドスキャフォールドに一般化して、それらの標的へのそれらの特異的結合を決定することもできる。結論として、このプロトコールは、固定化タンパク質抗原に対するrAbsの結合親和性を決定するプロセスを記載する。このプロセスでは、基本的な実験室技術を使用して、rAbを段階希釈して固定化抗原に添加します。最も困難な側面は、適切な形状の飽和結合曲線を生成するためにrAbの濃度を決定することである。このプロセスは、個々のrAbsに対するアッセイの開発において試行錯誤を必要とするが、確立されると再現可能であろう。計算されたKD は、イメージングまたは治療アプリケーションを進めるための基準として、または抗体キレートコンジュゲーション反応を改良するための基準として、免疫反応性のメトリックとして使用できます。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者には利益相反はありません。
Acknowledgments
著者らは、[89Zr]Zr-シュウ酸塩の生産に対して3D Imaging と、抗体を提供してくれたヤンセン・ファーマシューティカルズのシェリー・ムーアズ博士に感謝の意を表している。
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P. Radioligand binding assays and their analysis. in Receptor Binding Techniques. Davenport, A. P. , Humana Press. 31-77 (2012).
- Davenport, A. P., Russell, F. D. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. Mather, S. J. , Springer. Netherlands. 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).



