Summary
Här beskrivs en metod för att bestämma bindningsaffiniteten (KD) hos radioaktivt märkta antikroppar mot immobiliserade antigener. KD är jämviktsdissociationskonstanten som kan bestämmas från ett mättnadsbindande experiment genom att mäta den totala, specifika och ospecifika bindningen av en radiomärkt antikropp i olika koncentrationer till dess antigen.
Abstract
Bestämning av bindningsaffinitet (KD) är en viktig aspekt av karakteriseringen av radioaktivt märkta antikroppar (rAb). Typiskt representeras bindningsaffinitet av jämviktsdissociationskonstanten, KD, och kan beräknas som koncentrationen av antikroppar vid vilken hälften av antikroppsbindningsställena upptas vid jämvikt. Denna metod kan generaliseras till alla radioaktivt märkta antikroppar eller andra protein- och peptidställningar. Till skillnad från cellbaserade metoder är valet av immobiliserade antigener särskilt användbart för att validera bindande affiniteter efter långvarig lagring av antikroppar, särskilja bindande affiniteter av fragmentantigenbindande regionarmar (Fab) i bispecifika antikroppskonstruktioner och bestämma om det finns variation i antigenuttryck mellan olika cellinjer. Denna metod innefattar immobilisering av en fast mängd antigen till specificerade brunnar på en brytbar 96-brunnsplatta. Därefter blockerades ospecifik bindning i alla brunnar med bovint serumalbumin (BSA). Därefter tillsattes rAb i en koncentrationsgradient till alla brunnar. En rad koncentrationer valdes för att låta rAb nå mättnad, dvs en koncentration av antikroppar vid vilken alla antigener kontinuerligt binds av rAb. I utsedda brunnar utan immobiliserat antigen kan ospecifik bindning av rAb bestämmas. Genom att subtrahera ospecifik bindning från total bindning i brunnarna med immobiliserat antigen kan specifik bindning av rAb till antigenet bestämmas. KD för rAb beräknades utifrån den resulterande mättnadsbindningskurvan. Som ett exempel bestämdes bindningsaffinitet med användning av radioaktivt märkt amivantamab, en bispecifik antikropp för epidermal tillväxtfaktorreceptor (EGFR) och cytoplasmatiska mesenkymala epitelövergångsproteiner (cMET).
Introduction
Radioaktivt märkta antikroppar (rAb) har en mängd olika användningsområden inom medicin. Medan majoriteten används i onkologi som bildbehandling och terapeutiska medel, finns det bildapplikationer för reumatologirelaterad inflammation, kardiologi och neurologi1. Imaging rAbs har hög känslighet för att upptäcka lesioner och har potential att hjälpa till vid patientval för behandling 2,3,4,5. De används också för terapi på grund av deras specificitet för deras respektive antigener. I en strategi som kallas theranostics används samma rAb för både avbildning och behandling6.
Helst är den antikropp som valts för radiomärkning en som redan visat sig ha hög bindningsaffinitet och specificitet med hjälp av icke-radiomärkta metoder. Radiomärkning av antikroppar kan uppnås genom direkt kemisk modifiering av antikroppar med en radionuklid som bildar stabila kovalenta bindningar (t.ex. radiojod), eller indirekt via konjugering med kelatorer som därefter koordinerar till radiometaller 7,8. Direkt radiomärkning såsom med radiojod modifierar specifikt tyrosin och histidinrester på antikroppen. Om dessa rester är viktiga för antigenbindning, skulle denna radiokonjugering förändra bindningsaffiniteten. Omvänt finns det flera etablerade protokoll för konjugering och indirekt radiomärkning av antikroppar. Till exempel är en vanlig kelator som används för att binda zirkonium-89 (89Zr) för PET-avbildning av antikroppar p-isotiocyanatobenzyl-desferrioxamin (DFO), som konjugeras slumpmässigt till lysinrester av antikroppen 9,10. Om det finns lysinrester vid den antigenbindande regionen kan konjugering på dessa ställen steriskt hindra antigenbindning och därför äventyra antikropps-antigenbindningen. Således kan de olika radiokonjugeringsmetoderna som används för indirekt eller direkt radiomärkning av antikroppar potentiellt påverka immunoreaktiviteten, definierad som antikroppsradiokonjugatets förmåga att binda till dess antigen 7,11. Platsspecifika konjugeringsmetoder kan kringgå denna begränsning, men dessa tekniker kräver antikroppsteknik för att införliva ytterligare cysteinrester eller expertis inom enzymatiska reaktioner på kolhydratrester 12,13,14,15,16. När en antikropp är radioaktivt märkt är det viktigt att testa om immunoreaktivitet bibehålls som en del av karakteriseringen av rAb. Ett sätt att mäta immunoreaktivitet är att bestämma rAb:s bindningsaffinitet.
Syftet med detta protokoll är att beskriva en process för att bestämma bindningsaffiniteten för rAbs med hjälp av en etablerad radioligandmättnadsanalys för att kvantifiera rAb-antigenbindning. Den bindande trenden beskrivs i figur 1. Mängden antigen bunden kommer att öka när mer rAb tillsätts till en fast mängd immobiliserat antigen. När alla antigenbindande ställen är mättade kommer en platå att nås, och att lägga till fler rAbs kommer inte att ha någon effekt på mängden bundet antigen. I denna modell är jämviktsdissociationskonstanten (KD) koncentrationen av antikroppar som upptar hälften av antigenreceptorerna17. KD representerar hur väl en antikropp binder till sitt mål med en lägre KD som motsvarar en högre bindningsaffinitet. Det har tidigare rapporterats att en idealisk rAb bör ha en KD på 1 nanomolär eller mindre18. Nyare rAbs har dock utvecklats med KD i det låga nanomolära området och anses lämpliga för icke-invasiva bildapplikationer 19,20,21,22. En annan parameter som kan bestämmas i radioligandmättnadsanalysen av rAbs är Bmax, vilket motsvarar den maximala mängden antigenbindning. Bmax kan användas för att beräkna antalet antigenmolekyler om det behövs.

Figur 1: Representativ mättnadsbindningskurva. Procentandelen antigen bunden plottas mot ökande koncentrationer av antikroppar tillsatta till en fast mängd antigen. Pop-outs visar bindning på olika punkter. Koncentrationen och bindningen motsvarande KD respektive Bmax visas. Denna siffra skapades med BioRender.com. Klicka här för att se en större version av denna figur.
Denna analys är särskilt viktig för radioaktivt märkta bispecifika antikroppskonstruktioner för att bestämma KD för varje fragmentantigenbindande region (Fab) -arm av den radioaktivt märkta bispecifika antikroppsbindningen med deras respektive antigener. Detta protokoll kan användas för att bestämma KD för varje Fab-arm separat på immobiliserade antigener för att oberoende karakterisera huruvida bindningsaffiniteten hos varje Fab-arm för dess respektive antigen påverkades efter radiokonjugering. Detta protokoll demonstreras genom användning av radioaktivt märkt amivantamab, en bispecifik antikropp för epidermal tillväxtfaktorreceptor (EGFR) och cytoplasmatiska mesenkymala epitelövergångsproteiner (cMET)19. Radioaktivt märkta enarmade antikroppar, där en Fab-arm binder till EGFR (α-EGFR) eller till cMET (α-cMET) och den andra Fab-armen är en isotypkontroll, användes också som exempel19. Detta protokoll är också lämpligt för alla radioaktivt märkta antikroppar med ett känt antigen som kan immobiliseras. I detta protokoll tillsätts en utspädningsserie av rAb till en fast mängd immobiliserat antigen i utsedda brunnar som är specifika för varje Fab-arm i rAb. RAb tillsätts också till brunnar som endast har blockerats med bovint serumalbumin (BSA), utan antigen, för att bestämma ospecifik bindning. För att bestämma specifik bindning subtraheras ospecifik bindning till immobiliserat antigen från den totala rAb-bindningen. Den resulterande mättnadsbindningskurvan används sedan för att bestämma KD, som beskrivits ovan.
En fördel med denna metod är högre reproducerbarhet vid användning av renade antigener jämfört med att använda cellinjer som källa till antigener, med tanke på att antigenuttrycksnivåerna kan påverkas under cellodling och att olika cellinjer har varierande nivåer av antigenuttryck. När det gäller radioaktivt märkta bispecifika antikroppar kan cellinjer som endast uttrycker ett av antigenerna utan det andra inte vara tillgängliga, vilket skulle göra det mycket utmanande att karakterisera bindningsaffiniteten hos de enskilda Fab-armarna. I synnerhet är den viktigaste fördelen med radioligandmättnadsanalysmetoden jämfört med icke-radiomärkta metoder den specifika karakteriseringen av bindningsaffiniteten hos rAb utan bidrag från rAb: s okonjugerade fraktion. Såvitt författarna vet finns det för närvarande inga reningstekniker för att skilja rAb från dess överordnade okonjugerade antikropp. Med tanke på kelatorns och radionuklidens relativt lilla storlek är deras bidrag till den totala molekylvikten för rAb obetydlig i storleksuteslutningskromatografi. Således är produkten som genereras från någon radiomärkningsteknik nästan alltid en blandning av rAb och dess överordnade okonjugerade antikropp. Karakterisering av bindningsaffinitet med hjälp av den radioaktivt märkta mättnadsanalysen säkerställer att produkten som testas endast är rAb.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
OBS: Se figur 2 för en grafisk representation av protokollet.

Figur 2: Schematiskt protokoll. Rad- och kolumnetiketter anges som en guide för att ställa in den brytbara 96-brunnsplattan. Förväntad bindning visas i en exempelbrunn för antigenet och BSA. Den böjda pilen betecknar den rAb som förväntas tvättas ur brunnar med BSA endast. Denna siffra skapades med BioRender.com. Klicka här för att se en större version av denna figur.
1. Förberedelse av buffert
- Förbered 50 ml immobiliseringsbuffert (vattenlösning av 50 mMNa2CO3; pH = 9,0).
- Väg 191 mg NaHCO3 och 23,9 mgNa2CO3 på vägningspapper och överför till ett 50 ml koniskt rör. Tillsätt 40 ml 18 MΩ vatten och virvel för att lösa upp. Justera pH till 9,0 om det behövs innan du tar den totala volymen till 50 ml med 18 MΩ vatten.
- Förbered cirka 200 ml tvättbuffert (fosfatbuffrad saltlösning (PBS) innehållande 0,05% Tween-20) genom att tillsätta 200 ml PBS och sedan 100 μL Tween-20 till en 250 ml flaska.
- Förbered 50 ml bindningsbuffert (PBS innehållande 0,05% Tween-20 och 0,1% bovint serumalbumin (BSA)).
- Väg 50 mg BSA på vägningspapper och överför till ett 50 ml koniskt rör. Tillsätt 50 ml PBS och sedan 25 μL Tween-20 till röret. Vortex försiktigt att blanda.
- Förbered 50 ml blockerande buffert (3% BSA i PBS).
- Väg 1,5 g BSA på vägningspapper och överför till ett 50 ml koniskt rör. Tillsätt 50 ml PBS och virvel försiktigt för att blanda.
OBS: Alla buffertar rekommenderas att lagras i upp till 1 vecka vid 4 ° C för bästa resultat.
- Väg 1,5 g BSA på vägningspapper och överför till ett 50 ml koniskt rör. Tillsätt 50 ml PBS och virvel försiktigt för att blanda.
2. Antigen immobilisering
- Späd antigenet i immobiliseringsbufferten för att nå en koncentration på 5 μg / ml.
- Tillsätt 100 μL per brunn av antigen till botten av 24 brunnar i en brytbar 96-brunns, platt bottenplatta i en 8 x 3 matris (kolumnerna 1-3 för raderna A-H). Täck plattan med tätningstejp.
OBS: Se till att brunnsplattans yta hade behandlats för att maximera adsorptionen av blandade hydrofoba och hydrofila domäner. Dessa förbehandlade plattor är kommersiellt tillgängliga. - Inkubera vid 4 ° C över natten.
- Följande dag, tvätta plattan 3x med tvättbuffert.
- Invertera plattan snabbt i diskbänken för att kassera vätskan och knacka på plattan på en hög med pappershanddukar för att ta bort överflödig vätska.
- Använd en flerkanalig pipett, tillsätt 300 μL per brunn tvättbuffert till brunnar som innehåller antigenet. Avlägsna vätskan enligt beskrivningen i 2.4.1. Upprepa tvättsteget totalt tre gånger.
3. Blockering av ospecifika webbplatser med BSA
- Använd en flerkanalig pipett och tillsätt 300 μL per brunn av blockerande buffert till de 24 antigenbelagda brunnarna och 24 tomma brunnarna på 96-brunnsplattan (kolumnerna 1-6 för raderna A-H).
- Inkubera plattan i 1 timme vid omgivningstemperatur.
- Tvätta plattan med 300 μL per brunn av tvättbuffert totalt tre gånger. Se steg 2.4 för en detaljerad beskrivning av tvättplattan.
4. Seriella utspädningar och tillsats av rAb-lösningen
VARNING: Följande steg innebär radioaktivitet. Åtgärder bör endast utföras av dem med strålsäkerhetsutbildning. Forskare bör dubbla handsken och utföra steg med adekvat avskärmning.
- Syntetisera rAb som undersöks med hjälp av valfri metod. De rAbs som användes som exempel syntetiserades som beskrivits tidigare19.
OBS: Detta protokoll fokuserar på karakteriseringen av en rAb en gång radiomärkt. - Gör 8 x 3-faldiga seriella utspädningar (avsedda för raderna A-H på plattan) av rAb i bindningsbufferten.
OBS: Koncentrationerna av de seriella utspädningarna varierar för varje rAb. Detaljer diskuteras i avsnittet Diskussion. Om utspädningsfaktorn ändras bör den volym som behövs för varje utspädning räknas om för att säkerställa tillräcklig volym för 1) bindning av rAb i varje brunn, 2) sådd av följande utspädning och 3) aliering av en rAb-standardlösning för gammaräkning för att mäta radioaktiviteten hos den totala rAb som tillsätts till varje brunn.- Beräkna volymen av lager rAb som behövs för att göra en 1,2 ml lösning av den första koncentrationen (etikett som A).
- Tillsätt 800 μL bindningsbuffert till mikrocentrifugrör märkta B, C, D, ... till H. Tillsätt 1,2 ml minus den volym som beräknats i steg 4.2.1 av bindningsbufferten till ett mikrocentrifugrör märkt A.
- Lägg till volymen av lager rAb beräknad i 4.2.1 till rör A. Vortex försiktigt för att blanda och snurra sedan ner med en minimikrocentrifug för att samla all vätska i botten av röret.
- Tillsätt 400 μL från rör A till rör B. Vortex att blanda och sedan snurra ner med en minimikrocentrifug. Upprepa tillägg från B till C, C till D, ..., G till H.
- Tillsätt 100 μL per brunn av varje utspädning till tre brunnar immobiliserade med antigen och tre brunnar blockerade med endast BSA. Tillsätt till exempel utspädning A till brunnarna A1-A3 (antigen) och A4-A6 (BSA).
- Tillsätt 100 μL av varje utspädning till mikrocentrifugrör märkta A std - H std. Spara dessa rör som rAb-standarder som ska analyseras i gammaräknaren.
- Inkubera plattan i 1 timme vid 37 °C med lätt gungning.
5. Tvätta plattor och analysera radioaktivitet
- Märk mikrocentrifugrör för varje brunn (A1 till A6, B1 till B6 ... genom H1-H6). Använd två olika färgade markörer för att färgkoda prover om så önskas - en för brunnar belagda med antigen och en för brunnar med endast BSA.
- Aspirera rAb från varje brunn med hjälp av en vakuumsugare.
- Tillsätt 300 μL tvättbuffert till varje brunn med en flerkanalig pipett. Aspirera tvättbufferten. Upprepa tvätten totalt fem gånger.
- Bryt isär brunnarna i lämpliga mikrocentrifugrör.
- Räkna radioaktiviteten i rören med hjälp av en gammaräknare. Räkna först rören med antigenet (H1, H2, H3 till A1, A2, A3) och sedan de med endast BSA (H4, H5, H6 till A4, A5, A6). För att minimera störningar, räkna separat standarderna för varje utspädning (H std till A std) vid en annan tidpunkt.
6. Dataanalys
OBS: De kompletterande filerna innehåller motsvarande kalkylblad och statistiska analysmallar för att analysera och plotta data.
- I ett kalkylblad beräknar du den totala, specifika och ospecifika bindningen för varje exempel (se kalkylbladsmallen som bifogas som en tilläggsfil).
- Beräkna "Bunden aktivitet" som antalet per minut (CPM) av provet (erhållet från gammaräknaren) dividerat med CPM för lämplig standard. Beräkna "% bunden" som bunden aktivitet gånger 100.
- Beräkna "Total Bound, mol / L" genom att multiplicera "% Bound" med koncentrationen (mol / L) av den tillsatta rAb. Beräkna "Total Bound, mol" genom att multiplicera "Total Bound, mol / L" med volymen rAb tillsatt i liter (0,0001 L).
- Beräkna "Specifik bindning, mol" genom att subtrahera "Total Bound, mol" av BSA-utspädningarna från antigenutspädningarna så att A1 paras ihop med A4, A2 med A5, A3 med A6, B1 med B4, etc.
- Beräkna "Nonspecific Binding, mol" genom att subtrahera "Specific Binding, mol" från "Total Binding, mol" för varje brunn.
- I den statistiska analysplottningsprogramvaran plottar du koncentrationen av rAb tillsatt (nmol / L) på x-axeln kontra bindning (mol) på y-axeln. Skapa separata grupper för att rita i tredubbel total bindning, specifik bindning och ospecifik bindning. Utför en icke-linjär passformsanalys genom att välja följande parametrar i den programvara som används (Materialtabell; se den statistiska analysmallen som bifogas som en kompletterande fil).
- Välj Ny analys. Under XY-analyser väljer du Icke-linjär regression (kurvpassning). Kontrollera att alla data är markerade under Analysera vilka datauppsättningar? och välj sedan Ok.
- På fliken Modell , under Bindning - Mättnad, väljer du En plats - Specifik bindning. På fliken Förtroende väljer du Identifiera "tvetydiga" passformer. Lämna alla andra parametrar som standard och välj Ok.
OBS: Detta kommer att beräkna KD och Bmax för den totala, specifika och ospecifika bindningen. KD för den specifika bindningen är KD i nmol / L av rAb bunden till antigenet.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Denna metod beräknar bindningsaffinitet (KD) för en rAb baserat på mättnadsbindningsanalysen där olika koncentrationer av rAb tillsattes till en fast mängd immobiliserat antigen. Bindningskurvan bör följa logaritmisk tillväxt där den initialt är brant och sedan platåer när antigenet är mättat. För att säkerställa att den bestämda KD är korrekt måste koncentrationerna av rAb vara tillräckligt höga för att nå mättnad. För denna analys konjugerades radiomärkta antikroppar till DFO och radiomärktes med 89Zr, som tidigare beskrivits19. Figur 3 visar representativa mättnadsbindande diagram. Radioaktivt märkt amivantamab, en bispecifik antikropp för epidermal tillväxtfaktorreceptor (EGFR) och cytoplasmatiskt mesenkymalt epitelövergångsprotein (cMET), var bundet till EGFR (figur 3A) och cMET (figur 3B) proteiner19. Mättnadsbindande diagram visas också för de enarmade radiomärkta Fabs bundna till EGFR (figur 3C) och cMET (figur 3D) proteiner19. I alla delfigurer var icke-linjära regressionskurvor representativa för utspädningsserien med minimala extremvärden från kurvorna. Specifik bindning motsvarade merparten av den totala bindningen. Medan den ospecifika bindningen var låg totalt sett, visade högre koncentrationer av rAb större ospecifik bindning, vilket indikerar ett möjligt tröskelvärde för ospecifik bindning i denna analys. De bindande affiniteterna hos rAbs var i det förväntade nanomolära intervallet. KD-värdena på 8,4 ± 1,7 nM och 4,2 ± 1,5 nM för enarmens α-EGFR respektive α-cMET, visar en liknande affinitet för målantigenet som det bispecifika rAb med KD-värden på 9,9 ± 2,1 nM respektive 16,9 ± 5,9 nM för EGFR respektive cMET.
Suboptimala experiment för bindning av radioaktivt märkta α-cMET till immobiliserade cMET-proteiner visas i figur 4 för att visa resultaten av parametrar som kräver optimering. I figur 4A var koncentrationsområdet för tillsatt rAb för lågt och mättnaden uppnåddes inte, vilket indikeras av att bindningskurvan inte nådde en platå. Dessa förhållanden resulterade i ett linjärt diagram över koncentrationen av rAb tillsatt kontra bundet rAb. Eftersom data inte passar den icke-linjära regressionsmodellen bestämdes KD-värdet vara "tvetydigt" i den statistiska analysen. I figur 4B användes för höga koncentrationer för radioaktivt märkta α-cMET. Mättnad uppnåddes som indikeras av den horisontella platån i bindningskurvan. Ospecifik bindning bidrar emellertid märkbart till den totala bindningen. Dessa förhållanden resulterar i en stor mängd osäkerhet indikerad av ett KD-värde på 14,9 nM med ett stort 95% konfidensintervall på 4,8 - 44,2 nM. Således skulle optimering av koncentrationsområdet för tillsatt rAb, som visas i figur 3D, ge mer exakta KD-värden . Mättnadsbindningskurvan är baserad på Michaelis-Menten-ekvationen för reaktionskinetik. En kurva passar bra när punkterna fördelas slumpmässigt runt regressionslinjen17. Ett smalt konfidensintervall indikerar att KD-värdet är korrekt.

Figur 3: Mättnadsbindningsdiagram för att bestämma KD. Bindningskurvor för [89Zr]Zr-DFO-amivantamab till (A) EGFR- och (B) cMET-proteiner, (C) [89Zr]Zr-DFO-α-EGFR till EGFR-protein och (D) [89Zr]Zr-DFO-α-cMET till cMET-proteiner för att beräkna bindningsaffinitet. Felstaplar representerar standardavvikelsen för bunden 89Zr-märkt antikropp för varje koncentration. Medelvärde ± SD av KD och Bmax visas från tre oberoende experiment för varje tillstånd. Denna siffra återanvänds med tillstånd från Cavaliere et al19. Klicka här för att se en större version av denna figur.
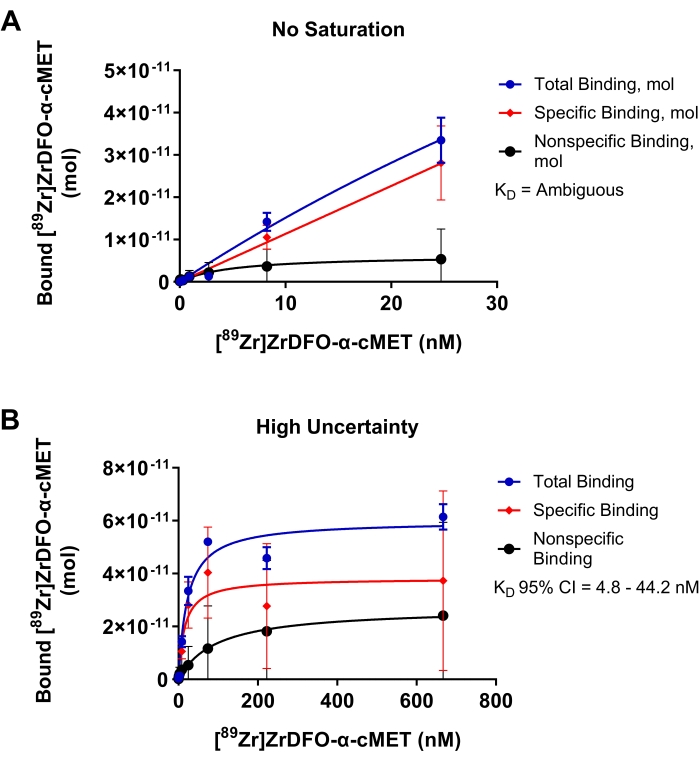
Figur 4: Mättnadsbindningsdiagram där KD inte kan bestämmas exakt. Bindning av [89Zr]Zr-DFO-α-cMET till cMET-proteiner. Felstaplar representerar standardavvikelsen för bunden [89Zr]Zr-DFO-α-cMET. (A) Koncentrationerna av [89Zr]Zr-DFO-α-cMET är för låga och mättnaden uppnås inte. KD kan inte beräknas eftersom kurvan är linjär och inte passar den icke-linjära regressionsmodellen. (B) Hög osäkerhet för den specifika bindningen indikeras av det breda 95% konfidensintervallet (CI) för KD (4,8-44,2 nM). Det finns också hög ospecifik bindning på grund av höga koncentrationer av rAb. Klicka här för att se en större version av denna figur.
Kompletterande filer. Klicka här för att ladda ner den här filen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Som en del av utvecklingen av rAbs är det viktigt att säkerställa att en rAb binder specifikt till sitt mål med hög bindningsaffinitet. Bestämning av bindningsaffinitet kan informera om immunoreaktiviteten hos rAb påverkas av radiokonjugering genom radioligandmättnadsanalysen med användning av immobiliserat antigen. Bestämning av rAb-bindning till BSA kan användas för att kvantifiera ospecifik bindning för att mäta specifik bindning till det immobiliserade antigenet mer exakt. Denna metod testar bindningen av olika koncentrationer av rAb för att generera en mättnadsbindande kurva för att beräkna KD och bestämma bindningsaffinitet.
För att utföra denna analys måste man ha antigenet för rAb under utredning. Antigenet måste ha epitopen som antikroppen binder till. I situationer där nya antikroppar har okända bindande epitoper kan icke-radiomärkta metoder för att bestämma bindningsaffinitet vara mer lämpliga. Innan experimentet påbörjas rekommenderas en litteratursökning. Antigener av intresse som tidigare har använts i ELISA-baserade analyser kommer sannolikt att vara effektiva för denna analys.
Beroende på halveringstiden för radionukliden och gammaräknarens känslighet kan det ta tid för standarderna att sönderfalla till en nivå av radioaktivitet som ligger inom gammaräknarens kvantitativa gränser. Om radioaktivitetsnivån förväntas vara för hög för gammaräknaren, späd standardproverna och multiplicera sedan med utspädningsfaktorn i dataanalysen. Detta steg bör göras på experimentdagen för att undvika risken för antikroppsaggregering eller nedbrytning som kan resultera i inhomogena standardlösningar och felaktig avläsning.
Generering av en lämpligt formad mättnadskurva baseras på den valda utspädningsserien. Denna process kommer att kräva försök och fel. Oförmågan att generalisera koncentrationerna av rAbs är en begränsning av protokollet, eftersom alla rAbs förväntas ha olika bindande affiniteter för sina antigener. Detta protokoll bör optimeras för varje rAb. När protokollet har optimerats bör det vara reproducerbart för den specifika rAb. Både koncentrationsområdet och utspädningsfaktorn kan behöva justeras baserat på kurvans form. Med tanke på det förväntade nanomolära intervallet för antikroppsbindning kommer man att börja med bredast möjliga representation av detta intervall så att man kan zooma in på ett smalare koncentrationsintervall av intresse för framtida försök. Istället för åtta seriella utspädningar skulle sexton ge fler datapunkter för att förstå bindningsområdet. Om KD för den okonjugerade antikroppen är känd rekommenderas att använda det värdet som en mellankoncentration av intervallet när studien först utformas. Beroende på tillgången på material kan flera pågående försök med olika koncentrationsintervall och utspädningsfaktorer optimera protokollet relativt snabbare. Inkubationstiden kan justeras för att säkerställa att mättnad uppnås. Dessutom, om bindningen är låg även vid mättnad, kanske det inte finns tillräckligt med signalområde för att exakt beräkna KD. Optimering av koncentrationen av immobiliserat antigen kan behövas. En förstudie kan utföras med olika koncentrationer av immobiliserat antigen och lagerkoncentrationen av rAb för att bestämma den maximala bindningssignalen.
Radioligandmättnadsanalys är en etablerad metod och har många fördelar, jämfört med andra icke-radiomärkta metoder såsom flödescytometri eller ytplasmonresonans (SPR), för att bestämma bindningsaffiniteten hos rAbs. Metoder som använder detektion av icke-radiomärkta antikroppar bestämmer bindningsaffiniteten hos ett blandat prov som består av både konjugerade och okonjugerade antikroppar. I radioligandmättnadsanalys är den enda registrerade signalen den för det radioaktivt märkta antikroppskonjugatet, vilket ger en mer exakt KD för de radiomärkta arterna som skulle påverka den biomedicinska tillämpningen. Detta övervägande gör resultaten från radioligandmättnadsanalys och de från icke-radiomärkta tekniker praktiskt taget ojämförliga eftersom de mäter olika prover - rAb vs rAb plus föräldraantikropp. En studie jämförde bindningsaffiniteten hos icke-radiomärkt antikroppskelatorkonjugat och föräldrabispecifik antikropp med SPR på immobiliserade proteiner. Det fanns en femfaldig skillnad mellan KD-värdena för antikroppskelatorkonjugatet och föräldraantikroppen. Skillnaden i KD-värden som hittades mellan SPR och en mättnadsanalys på flera cellinjer varierade från 10- till 1000-faldigt23. Den icke-radiomärkta antikroppkelatorn är en blandning av konjugerade och okonjugerade antikroppar, medan K D-värdena som bestäms av mättnadsanalysen endast kommer från den radioaktivt märkta konjugerade antikroppen. Det finns också variation i antigenuttryck mellan de använda cellinjerna. Således kan icke-radiomärkta tekniker inte användas för att validera radioligandmättnadsanalysen. När kD för rAb har fastställts kan emellertid en konkurrenskraftig bindningsanalys utföras för att bestämma skillnader i bindning mellan de föräldra- och konjugerade varianterna av antikroppen17,21.
Radioligandmättnadsanalysen kan utvidgas för att bestämma mättnadsbindningen av rAb till celler snarare än immobiliserat antigen. Med hjälp av samma begrepp kan olika koncentrationer av rAb läggas till ett fast antal celler. Dataanalysen som beskrivs i protokollet kan sedan användas för att bestämma bindningsaffiniteten hos rAb till cellerna, vilket också skulle bestämma Bmax för att beräkna antalet antigenmolekyler som finns på cellinjen av intresse. Denna metod kan också generaliseras till andra radioaktivt märkta protein- och peptidställningar för att bestämma deras specifika bindning till sina mål. Sammanfattningsvis beskriver detta protokoll processen för att bestämma bindningsaffiniteten hos rAbs till immobiliserade proteinantigener. Processen använder grundläggande laboratorietekniker för att göra seriella utspädningar av rAb för att lägga till det immobiliserade antigenet. Den mest utmanande aspekten är att bestämma koncentrationerna av rAb för att generera en lämpligt formad mättnadsbindningskurva. Denna process kräver försök och fel i utvecklingen av analysen för enskilda rAbs men skulle då vara reproducerbar när den väl har fastställts. Den beräknade KD kan användas som ett mått på immunoreaktivitet som ett kriterium för att gå vidare med avbildnings- eller terapiapplikationer, eller för att förfina antikroppskelatkonjugationsreaktionen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har inga intressekonflikter.
Acknowledgments
Författarna tackar 3D Imaging för produktionen av [89Zr] Zr-oxalat och Dr. Sheri Moores vid Janssen Pharmaceuticals för att tillhandahålla antikroppar.
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P. Radioligand binding assays and their analysis. in Receptor Binding Techniques. Davenport, A. P. , Humana Press. 31-77 (2012).
- Davenport, A. P., Russell, F. D. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. Mather, S. J. , Springer. Netherlands. 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).



