Summary
Aqui, um método é descrito para determinar a afinidade vinculante (KD) de anticorpos radiolabelados a antígenos imobilizados. KD é a constante de dissociação de equilíbrio que pode ser determinada a partir de um experimento de ligação de saturação medindo a ligação total, específica e inespecífica de um anticorpo radiolabeled em várias concentrações ao seu antígeno.
Abstract
Determinar a afinidade vinculante (KD) é um aspecto importante da caracterização de anticorpos radiolabeled (rAb). Normalmente, a afinidade vinculante é representada pela constante de dissociação de equilíbrio, KD, e pode ser calculada como a concentração de anticorpos em que metade dos locais de ligação de anticorpos são ocupados em equilíbrio. Este método pode ser generalizado para qualquer anticorpo radiolabeled ou outros andaimes de proteína e peptídeos. Em contraste com os métodos baseados em células, a escolha de antígenos imobilizados é particularmente útil para validar afinidades de ligação após o armazenamento de anticorpos a longo prazo, distinguindo afinidades vinculantes de braços da região de ligação de antígenos fragmentados (Fab) em construções de anticorpos bisespecíficos, e determinando se há variabilidade na expressão de antígeno entre diferentes linhas celulares. Este método envolve a imobilização de uma quantidade fixa de antígeno para poços especificados em uma placa de 96 poços quebráveis. Em seguida, a ligação inespecífica foi bloqueada em todos os poços com albumina de soro bovino (BSA). Posteriormente, a RAB foi adicionada em um gradiente de concentração a todos os poços. Uma série de concentrações foi escolhida para permitir que a RAB alcançasse a saturação, ou seja, uma concentração de anticorpos em que todos os antígenos são continuamente ligados pela RAB. Em poços designados sem antígeno imobilizado, pode ser determinada ligação inespecífica da RAB. Subtraindo a vinculação inespecífica da ligação total nos poços com antígeno imobilizado, pode-se determinar a ligação específica da RAB ao antígeno. O KD do rAb foi calculado a partir da curva de ligação de saturação resultante. Como exemplo, a afinidade vinculante foi determinada usando proteínas de amivantamab radiolabeled, um anticorpo bispecífico para receptor de fator de crescimento epidérmico (EGFR) e proteínas de transição mesenquimal-epitelial citoplasmática (cMET).
Introduction
Anticorpos radiolabeled (rAb) têm uma variedade de usos na medicina. Enquanto a maioria é utilizada na oncologia como agentes de imagem e terapêutica, existem aplicações de imagem para inflamação, cardiologia e neurologiarelacionadas à reumatologia 1. As imagens têm alta sensibilidade para detectar lesões e têm potencial para auxiliar na seleção do paciente para tratamento 2,3,4,5. Eles também são usados para terapia devido à sua especificidade para seus respectivos antígenos. Em uma estratégia conhecida como teranostics, o mesmo rAb é usado tanto para imagem quanto para tratamento6.
Idealmente, o anticorpo escolhido para radiolabeling é um já comprovado ter alta afinidade vinculante e especificidade usando métodos não radiolabeled. A rotulagem radiolaclante de anticorpos pode ser alcançada através de modificação química direta de anticorpos com um radionuclídeo que forma ligações covalentes estáveis (por exemplo, radioiodina), ou indiretamente através de conjugação com queladores que posteriormente coordenam para radiometals 7,8. A rotulagem direta, como com radioiodina, modifica especificamente os resíduos de tyrosina e histidina no anticorpo. Se esses resíduos são importantes para a ligação de antígeno, então essa radioconjugação alteraria a afinidade de ligação. Por outro lado, existem vários protocolos estabelecidos para a conjugação e radiolabelação indireta de anticorpos. Por exemplo, um quedoro comum usado para ligar zircônio-89 (89Zr) para imagem PET de anticorpos é o p-isothiocyanatobenzyl-desferrioxamina (DFO), que é conjugado aleatoriamente para resíduos de lise de lysina do anticorpo 9,10. Se houver resíduos de lise na região de ligação de antígenos, a conjugação nesses locais pode dificultar a ligação de antígeno e, portanto, comprometer a ligação anticorpo-antígeno. Assim, os diferentes métodos de radioconjugação utilizados para radiolabeltação indireta ou direta de anticorpos podem potencialmente afetar a imunoreatividade, definida como a capacidade do radioconjugado de anticorpos de se ligar ao seu antígeno 7,11. Métodos de conjugação específicos do local podem contornar essa limitação, mas essas técnicas requerem engenharia de anticorpos para incorporar resíduos adicionais de cisteína ou experiência em reações enzimáticas em resíduos de carboidratos 12,13,14,15,16. Uma vez que um anticorpo é radiola rotulado, é importante testar se a imunoreatividade é mantida como parte da caracterização da rAb. Uma maneira de medir a imunoreatividade é determinar a afinidade vinculante da RAB.
O objetivo deste protocolo é descrever um processo para determinar a afinidade vinculante para rAbs usando um ensaio de radioligidade e saturação estabelecido para quantificar a ligação rAb-antígeno. A tendência de vinculação está descrita na Figura 1. A quantidade de antígeno ligado aumentará à medida que mais rAb for adicionado a uma quantidade fixa de antígeno imobilizado. Uma vez que todos os locais de ligação de antígenos estejam saturados, um platô será atingido, e adicionar mais rAbs não terá efeito sobre a quantidade de antígeno ligado. Neste modelo, a constante de dissociação de equilíbrio (KD) é a concentração de anticorpos que ocupa metade dos receptores de antígeno17. O KD representa o quão bem um anticorpo se liga ao seu alvo com um KD inferior correspondente a uma maior afinidade de ligação. Foi relatado anteriormente que um rAb ideal deveria ter um KD de 1 nanomolar ou menos18. No entanto, os rAbs mais recentes foram desenvolvidos com KD na faixa de nanomolar baixo, e são considerados adequados para aplicações de imagem não invasivas 19,20,21,22. Outro parâmetro que pode ser determinado no ensaio de radiolig e saturação de rAbs é bmax, que corresponde à quantidade máxima de ligação de antígeno. Bmax pode ser usado para calcular o número de moléculas de antígeno, se necessário.

Figura 1: Curva de ligação de saturação representativa. A porcentagem de antígeno ligado é plotada contra o aumento das concentrações de anticorpos adicionados a uma quantidade fixa de antígeno. Pop-outs demonstram vinculação em vários pontos. A concentração e a ligação correspondentes a KD e Bmax, respectivamente, são mostradas. Este número foi criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.
Este ensaio é particularmente importante para construções de anticorpos bisespecíficos radiolabeled para determinar o KD para cada fragmento braço de região de ligação de antígeno (Fab) do anticorpo bisespecífico radiolabeled que se liga com seus respectivos antígenos. Este protocolo pode ser usado para determinar o KD de cada braço Fab separadamente em antígenos imobilizados para caracterizar independentemente se a afinidade vinculante de cada braço Fab para seu respectivo antígeno foi afetada após a radioconjugação. Este protocolo é demonstrado pelo uso de amivantamab radiolabeled, um anticorpo bispecífico para receptor de fator de crescimento epidérmico (EGFR) e proteínas de transição mesenquimal-epitelial citoplasmática (cMET)19. Anticorpos de braço único radiolabeled, onde um braço Fab se liga ao EGFR (α-EGFR) ou ao cMET (α-cMET) e o outro braço Fab é um controle de isótipo, também foram usados como exemplos19. Este protocolo também é apropriado para qualquer anticorpo radiolabeled com um antígeno conhecido que pode ser imobilizado. Neste protocolo, uma série de diluição da rAb é adicionada a uma quantidade fixa de antígeno imobilizado em poços designados específicos para cada braço Fab da rAb. O rAb também é adicionado a poços que só foram bloqueados com albumina de soro bovino (BSA), sem antígeno, para determinar a vinculação inespecífica. Para determinar a vinculação específica, a ligação inespecífica ao antígeno imobilizado é subtraída da vinculação total da RAB. A curva de ligação de saturação resultante é então usada para determinar KD, conforme descrito acima.
Uma vantagem deste método é a maior reprodutibilidade ao usar antígenos purificados em comparação com o uso de linhas celulares como fonte de antígenos, dado que os níveis de expressão de antígeno poderiam ser afetados durante a cultura celular e que diferentes linhas celulares têm níveis variáveis de expressão de antígeno. No caso de anticorpos bisespecíficos radiolabeled, linhas celulares que só expressam um dos antígenos sem o outro podem não estar disponíveis, o que tornaria muito desafiadora a caracterização da afinidade vinculante dos braços fab individuais. Notavelmente, a principal vantagem do método de ensaio radiolig e saturação sobre métodos não radiolabeled é a caracterização específica da afinidade vinculante do RAB sem a contribuição da fração não conjugada da RAB. Para o melhor do conhecimento dos autores, atualmente não há técnicas de purificação para separar o RAB de seu anticorpo não julgado pai. Dado o tamanho relativamente pequeno do quequeador e radionuclídeo, sua contribuição para o peso molecular geral da RAB é insignificante na cromatografia de exclusão de tamanho. Assim, o produto gerado a partir de qualquer técnica de radiolabeling é quase sempre uma mistura do rAb e seu anticorpo não julgado pai. Caracterizar afinidade vinculante usando o ensaio de saturação radiolabeled garante que o produto que está sendo testado seja apenas o rAb.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOTA: Consulte a Figura 2 para uma representação gráfica do protocolo.

Figura 2: Esquema do protocolo. Os rótulos de linha e coluna são indicados como um guia para configurar a placa de 96 poços quebráveis. A ligação antecipada é mostrada em um exemplo bem para o antígeno e o BSA. A seta curva designa o rAb que deverá ser lavado de poços apenas com BSA. Este número foi criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.
1. Preparação do buffer
- Prepare 50 mL de tampão de imobilização (solução aquosa de 50 mM Na2CO3; pH = 9,0).
- Pesar 191 mg de NaHCO3 e 23,9 mgs de Na2CO3 em papel de pesagem e transferir para um tubo cônico de 50 mL. Adicione 40 mL de 18 MΩ de água e vórtice para dissolver. Ajuste o pH para 9,0 se necessário antes de levar o volume total para 50 mL com água de 18 MΩ.
- Prepare aproximadamente 200 mL de tampão de lavagem (salina tampão-fosfato tampão (PBS) contendo 0,05% Tween-20) adicionando 200 mL de PBS e depois 100 μL de Tween-20 a uma garrafa de 250 mL.
- Prepare 50 mL de tampão de ligação (PBS contendo 0,05% Tween-20 e 0,1% de albumina de soro bovino (BSA)).
- Pese 50 mg de BSA no papel de pesagem e transfira para um tubo cônico de 50 mL. Adicione 50 mL de PBS e depois 25 μL de Tween-20 ao tubo. Vórtice suavemente para misturar.
- Prepare 50 mL de tampão de bloqueio (3% BSA em PBS).
- Pese 1,5 g de BSA no papel de pesagem e transfira para um tubo cônico de 50 mL. Adicione 50 mL de PBS e vórtice suavemente para misturar.
NOTA: Recomenda-se que todos os buffers sejam armazenados por até 1 semana a 4 °C para melhores resultados.
- Pese 1,5 g de BSA no papel de pesagem e transfira para um tubo cônico de 50 mL. Adicione 50 mL de PBS e vórtice suavemente para misturar.
2. Imobilização de antígeno
- Diluir o antígeno no tampão de imobilização para atingir uma concentração de 5 μg/mL.
- Adicione 100 μL por poço de antígeno ao fundo de 24 poços de uma placa de fundo plana de 96 poços em uma matriz 8 x 3 (colunas 1-3 para as linhas A-H). Cubra a placa com fita de vedação.
NOTA: Certifique-se de que a superfície do poço tenha sido tratada para maximizar a adsorção de domínios hidrofóbicos e hidrofílicos mistos. Estas placas pré-tratadas estão disponíveis comercialmente. - Incubar a 4 °C durante a noite.
- No dia seguinte, lave a placa 3x com tampão de lavagem.
- Inverta a placa rapidamente na pia para descartar o líquido e bata a placa em uma pilha de toalhas de papel para remover o excesso de líquido.
- Usando uma pipeta multicanal, adicione 300 μL por poço de tampão de lavagem a poços que contenham o antígeno. Remova o líquido conforme descrito em 2.4.1. Repita a etapa de lavagem um total de três vezes.
3. Bloqueio de locais não específicos com BSA
- Usando uma pipeta multicanal, adicione 300 μL por poço de tampão de bloqueio aos 24 poços revestidos de antígeno e 24 poços vazios da placa de 96 poços (colunas 1-6 para as linhas A-H).
- Incubar a placa por 1h em temperatura ambiente.
- Lave a placa com 300 μL por poço de tampão de lavagem um total de três vezes. Consulte a etapa 2.4 para obter uma descrição detalhada da lavagem da placa.
4. Diluições seriais e adição da solução rAb
ATENÇÃO: As seguintes etapas envolvem radioatividade. As etapas só devem ser realizadas por aqueles com treinamento de segurança de radiação. Os pesquisadores devem dobrar a luva e executar etapas com blindagem adequada.
- Sintetizar o RAB sob investigação usando o método de escolha. Os rAbs usados como exemplo foram sintetizados como descrito anteriormente19.
NOTA: Este protocolo se concentra na caracterização de um rAb uma vez rotulado por rádio. - Faça diluições de série de 8 x 3 vezes (designadas para as linhas A-H na placa) do rAb no buffer de ligação.
NOTA: As concentrações das diluições seriais variam para cada rAb. Os detalhes são discutidos na seção Discussão. Se o fator de diluição mudar, o volume necessário para cada diluição deve ser recalculado para garantir volume suficiente para 1) vinculação do rAb em cada poço, 2) semeando a seguinte diluição e 3) aliquotando uma solução padrão rAb para contagem de gama para medir a radioatividade do rAb total adicionado a cada poço.- Calcule o volume de estoque rAb necessário para fazer uma solução de 1,2 mL da primeira concentração (rótulo como A).
- Adicione 800 μL de tampão de ligação aos tubos de microcentrifuuge rotulados B, C, D, ... para H. Adicione 1,2 mL menos o volume calculado na etapa 4.2.1 do buffer de ligação a um tubo de microcentrífuga rotulado A.
- Adicione o volume de rAb calculado em 4.2.1 para o tubo A. Vórtice suavemente para misturar e, em seguida, girar para baixo usando um mini microcentrifuuge para coletar todo o líquido na parte inferior do tubo.
- Adicione 400 μL do tubo A ao tubo B. Vórtice para misturar e, em seguida, girar para baixo usando um mini microcentrifuge. Repita a adição de B a C, C a D, ..., G a H.
- Adicione 100 μL por poço de cada diluição a três poços imobilizados com antígeno e três poços bloqueados apenas com BSA. Por exemplo, adicione diluição A aos poços A1-A3 (antígeno) e A4-A6 (BSA).
- Adicione 100 μL de cada diluição aos tubos de microcentrifusagem rotulados de DST - H std. Guarde esses tubos como padrões rAb a serem testados no contador gama.
- Incubar a placa por 1h a 37 °C com balanço suave.
5. Lavar placas e avaliar radioatividade
- Rotular tubos de microcentrifuuge para cada poço (A1 a A6, B1 a B6 ... através de H1-H6). Use dois marcadores coloridos diferentes para amostras de código de cor, se desejar-um para poços revestidos com antígeno e um para poços apenas com BSA.
- Aspire o rAb de cada poço usando um aspirador de vácuo.
- Usando uma pipeta multicanal, adicione 300 μL de tampão de lavagem a cada poço. Aspire o tampão de lavagem. Repita a lavagem um total de cinco vezes.
- Desmonte os poços nos tubos de microcentrifuuagem apropriados.
- Conte a radioatividade nos tubos usando um contador gama. Conte primeiro os tubos com o antígeno (H1, H2, H3 a A1, A2, A3), e depois aqueles com BSA apenas (H4, H5, H6 a A4, A5, A6). Para minimizar a interferência, conte separadamente as normas para cada diluição (H std to A std) em um momento diferente.
6. Análise de dados
NOTA: Os arquivos suplementares contêm modelos correspondentes de planilha e análise estatística para análise e plotagem dos dados.
- Em uma planilha, calcule a vinculação total, específica e não específica para cada amostra (consulte o modelo de planilha anexado como um arquivo suplementar).
- Calcule "Atividade Vinculada" como contagem por minuto (CPM) da amostra (obtida a partir do contador gama) dividida pelo CPM da norma apropriada. Calcule "% Vinculado" como Atividade Vinculada vezes 100.
- Calcule "Total Bound, mol/L" multiplicando "% Vinculado" com a concentração (mol/L) da rAb adicionada. Calcule "Total Bound, mol" multiplicando "Total Bound, mol/L" com o volume de rAb adicionado em litros (0,0001 L).
- Calcule "Ligação específica, mol" subtraindo "Total Bound, mol" das diluições BSA das diluições de antígeno, de modo que A1 emparelhe com A4, A2 com A5, A3 com A6, B1 com B4, etc.
- Calcule "Vinculação inespecífica, mol" subtraindo "Ligação específica, mol" de "Total Binding, mol" para cada poço.
- No software de plotagem de análise estatística, plote a concentração de rAb adicionada (nmol/L) no eixo x versus vinculação (mol) no eixo y. Crie grupos separados para traçar em vinculação total triplicada, vinculação específica e vinculação inespecífica. Realize uma análise de ajuste não linear selecionando os seguintes parâmetros no software utilizado (Tabela de Materiais; consulte o modelo de análise estatística anexado como um arquivo suplementar).
- Selecione Nova Análise. Em análises XY, selecione regressão não linear (ajuste de curva). Certifique-se de que todos os dados estão selecionados em Analisar quais conjuntos de dados e, em seguida, selecione Ok.
- Na guia Modelo , em Vinculação - Saturação, selecione Um site - Vinculação específica. Na guia Confiança , selecione Identificar ajustes 'ambíguos'. Deixe todos os outros parâmetros como padrão e selecione Ok.
NOTA: Isso calculará o KD e o Bmax para a ligação total, específica e não específica. O KD da ligação específica é o KD em nmol/L do rAb ligado ao antígeno.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Este método calcula a afinidade de ligação (KD) para um rAb com base no ensaio de ligação de saturação onde diferentes concentrações de rAb foram adicionadas a uma quantidade fixa de antígeno imobilizado. A curva de ligação deve seguir o crescimento logarítmico, onde é inicialmente íngreme e, em seguida, planaltos como o antígeno está saturado. Para garantir que o KD determinado seja preciso, as concentrações de rAb devem ser altas o suficiente para alcançar a saturação. Para este ensaio, os anticorpos radiolabeled foram conjugados ao DFO e radiolabeled com 89Zr, como descrito anteriormente19. A Figura 3 mostra parcelas representativas de saturação. Amivantamab radiolabeled, um anticorpo bispecífico para receptor de fator de crescimento epidérmico (EGFR) e proteínas de transição mesenquimal-epitelial citoplasmica (cMET), foi vinculado às proteínas EGFR (Figura 3A) e cMET (Figura 3B)19. As tramas de ligação de saturação também são mostradas para as proteínas de ligação radiolaterizada de braço único vinculadas às proteínas EGFR (Figura 3C) e cMET (Figura 3D)19. Em todas as subfiguras, as curvas de regressão não linear foram representativas da série de diluição com outliers mínimos das curvas. A vinculação específica correspondeu à maior parte da vinculação total. Embora a vinculação não específica tenha sido baixa no geral, as concentrações mais elevadas de rAb apresentaram maior vinculação inespecífica, indicando um possível limiar para vinculação inespecífica neste ensaio. As afinidades vinculantes dos rAbs estavam na faixa de nanomolar esperada. Os valores KD de 8,4 ± 1,7 nM e 4,2 ± 1,5 nM para o α-EGFR de braço único e α-cMET, respectivamente, demonstram afinidade semelhante ao antígeno alvo como o rAb bispecífico com valores KD de 9,9 ± 2,1 nM e 16,9 ± 5,9 nM para EGFR e cMET, respectivamente.
Experimentos subótimos para a vinculação de α-cMET radiolabeled a proteínas cMET imobilizadas são mostrados na Figura 4 para demonstrar os resultados de parâmetros que requerem otimização. Na Figura 4A, a faixa de concentração de rAb adicionada era muito baixa, e a saturação não foi atingida, como indicado pela curva de ligação não atingindo um platô. Essas condições resultaram em um gráfico linear da concentração de rAb adicionado versus rAb vinculado. Uma vez que os dados não se encaixam no modelo de regressão não linear, o valor de KD foi determinado como "ambíguo" na análise estatística. Na Figura 4B, foram utilizadas concentrações muito altas para α-cMET radiolabeled. A saturação foi alcançada conforme indicado pelo platô horizontal da curva de ligação. No entanto, a vinculação inespecífica contribui visivelmente para a vinculação total. Essas condições resultam em uma alta quantidade de incerteza indicada por um valor KD de 14,9 nM com um grande intervalo de confiança de 95% de 4,8 - 44,2 nM. Assim, otimizar a faixa de concentração de rAb adicionada, como mostrado na Figura 3D, forneceria valores KD mais precisos. A curva de ligação de saturação é baseada na equação de Michaelis-Menten para cinética de reação. Uma curva é um bom ajuste quando os pontos são distribuídos aleatoriamente em torno da linha de regressão17. Um intervalo de confiança estreito indica que o valor KD é preciso.

Figura 3: Parcelas de ligação de saturação para determinar KD. Curvas de ligação de [89Zr]Zr-DFO-amivantamab para (A) proteínas EGFR e (B) cMET, (C) [89Zr]Zr-DFO-α-EGFR à proteína EGFR, e (D) [89Zr]Zr-DFO-α-cMET às proteínas cMET para calcular a afinidade vinculante. As barras de erro representam o desvio padrão do anticorpo com 89Zr para cada concentração. Os ± SD médios de KD e Bmax são mostrados a partir de três experimentos independentes para cada condição. Este valor é reutilizado com permissão de Cavaliere et al19. Clique aqui para ver uma versão maior desta figura.
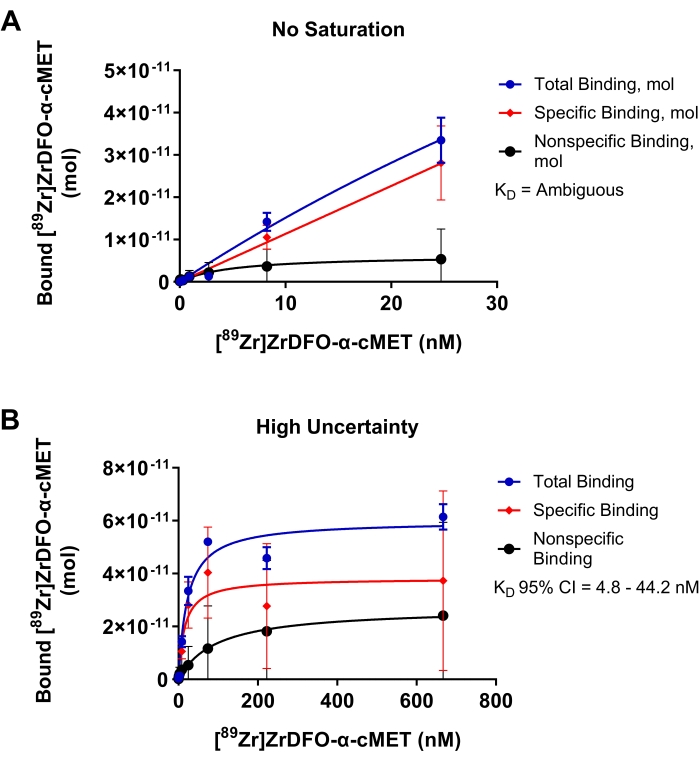
Figura 4: Parcelas de ligação de saturação onde KD não pode ser determinada com precisão. Vinculação de [89Zr]Zr-DFO-α-cMET às proteínas cMET. As barras de erro representam o desvio padrão do bound [89Zr]Zr-DFO-α-cMET. (A) As concentrações de [89Zr]Zr-DFO-α-cMET são muito baixas e a saturação não é atingida. KD não pode ser calculado, pois a curva é linear e não se encaixa no modelo de regressão não linear. (B) A alta incerteza para a vinculação específica é indicada pelo amplo intervalo de confiança de 95% (IC) para KD (4,8-44,2 nM). Há também alta vinculação inespecífica devido a altas concentrações de RAB. Clique aqui para ver uma versão maior desta figura.
Arquivos Suplementares. Clique aqui para baixar este Arquivo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Como parte do desenvolvimento de rAbs, é importante garantir que um rAb se ligue especificamente ao seu alvo com alta afinidade de ligação. A determinação da afinidade vinculante pode informar se a imunoreatividade da RAB é afetada pela radioconjugação através do ensaio de radioligidade e saturação usando antígeno imobilizado. A determinação da vinculação rAb ao BSA pode ser usada para quantificar a vinculação inespecífica para medir a vinculação específica ao antígeno imobilizado com mais precisão. Este método testa a vinculação de diferentes concentrações de rAb para gerar uma curva de ligação de saturação para calcular o KD e determinar a afinidade de ligação.
Para realizar este ensaio, é preciso ter o antígeno para a RAB sob investigação. O antígeno precisa ter a epítope à qual o anticorpo se liga. Em situações em que novos anticorpos têm epítopos vinculantes desconhecidos, métodos não rotulados de determinar afinidade vinculante podem ser mais apropriados. Antes de iniciar o experimento, recomenda-se uma pesquisa de literatura. Antígenos de interesse que já foram usados anteriormente em ensaios baseados em ELISA provavelmente serão eficazes para este ensaio.
Dependendo da meia-vida do radionuclídeo e da sensibilidade do contador gama, pode levar tempo para que os padrões decaam para um nível de radioatividade que está dentro dos limites quantitativos do contador gama. Se o nível de radioatividade for previsto para ser muito alto para o contador gama, dilui as amostras padrão e, em seguida, multiplicar-se pelo fator de diluição na análise dos dados. Essa etapa deve ser feita no dia do experimento para evitar a possibilidade de agregação ou degradação de anticorpos que possam resultar em soluções padrão inhomogenous e leitura imprecisa.
A geração de uma curva de saturação em forma apropriada baseia-se na série de diluição escolhida. Este processo exigirá tentativa e erro. A incapacidade de generalizar as concentrações de rAbs é uma limitação do protocolo, uma vez que todos os rAbs devem ter diferentes afinidades vinculantes para seus antígenos. Este protocolo deve ser otimizado para cada rAb. Uma vez otimizado, o protocolo deve ser reproduzido para o rAb específico. Tanto a faixa de concentração quanto o fator de diluição podem precisar ser ajustados com base na forma da curva. Dada a faixa de nanomolar esperada para ligação de anticorpos, a partir da representação mais ampla possível desta faixa permitirá que um zoom em uma faixa de concentração mais estreita de interesse para testes futuros. Em vez de oito diluições seriais, dezesseis forneceriam mais pontos de dados para entender o alcance da vinculação. Se o KD do anticorpo não conjugado for conhecido, recomenda-se usar esse valor como uma concentração média da faixa ao projetar pela primeira vez o estudo. Dependendo da disponibilidade de materiais, ter vários ensaios em andamento com diferentes faixas de concentração e fatores de diluição pode otimizar o protocolo relativamente mais rápido. O tempo de incubação pode ser ajustado para garantir que a saturação seja alcançada. Além disso, se a ligação for baixa mesmo na saturação, pode não haver alcance suficiente de sinal para calcular com precisão o KD. Pode ser necessário otimizar a concentração de antígeno imobilizado. Um estudo preliminar pode ser realizado com diferentes concentrações de antígeno imobilizado e concentração de estoque de rAb para determinar o sinal máximo de ligação.
O ensaio de radioligidade e saturação é um método estabelecido e tem muitos benefícios, comparado com outros métodos não radiolabeled, como citometria de fluxo ou ressonância de plasmon superficial (SPR), para determinar a afinidade vinculante dos rAbs. Métodos que empregam a detecção de anticorpos não radiolabelados determinam a afinidade vinculante de uma amostra mista composta pelos anticorpos conjugados e não julgados. No ensaio de radiolig e saturação, o único sinal registrado é o do conjugado de anticorpos radiolabeled, que fornece um KD mais preciso para as espécies radiolabeled que impactariam a aplicação biomédica. Essa consideração torna os resultados do ensaio radiolig e saturação e aqueles de técnicas não radiolabeled praticamente incomparáveis à medida que medem diferentes amostras - rAb vs. rAb mais anticorpo parental. Um estudo comparou a afinidade vinculante do conjugador de anticorpos não radiolabeled-chelator e o anticorpo bispecífico parental usando SPR em proteínas imobilizadas. Houve uma diferença de cinco vezes entre os valores KD do conjugado anticorpo-quequerador e anticorpo parental. A diferença nos valores de KD encontrados entre SPR e um ensaio de saturação em múltiplas linhas celulares variou de 10 a 1.000 vezes23. O anticorpo-chelator não radiolabelado é uma mistura de anticorpos conjugados e não julgados, enquanto os valores KD determinados pelo ensaio de saturação são apenas do anticorpo conjugado radiolabeled. Há também variação na expressão de antígeno entre as linhas celulares utilizadas. Assim, técnicas não radiolabeled não podem ser utilizadas para validar o ensaio de radioligagem e saturação. No entanto, uma vez determinado o KD do rAb, um ensaio de vinculação competitiva pode ser realizado para determinar diferenças de ligação entre as variantes parental e conjugadas do anticorpo17,21.
O ensaio de radioligização e saturação pode ser estendido para determinar a ligação de saturação da RAB às células em vez de antígeno imobilizado. Usando os mesmos conceitos, diferentes concentrações de rAb podem ser adicionadas a um número fixo de células. A análise de dados descrita no protocolo pode então ser usada para determinar a afinidade vinculante da RAB com as células, o que também determinaria bmax para calcular o número de moléculas de antígeno presentes na linha celular de interesse. Este método também pode ser generalizado para outros andaimes de proteína radiolabeled e peptídeos para determinar sua ligação específica aos seus alvos. Em conclusão, este protocolo descreve o processo de determinação da afinidade vinculante dos RAbs com antígenos proteicos imobilizados. O processo utiliza técnicas básicas de laboratório para fazer diluições seriais da RAB para adicionar ao antígeno imobilizado. O aspecto mais desafiador é determinar as concentrações da rAb para gerar uma curva de ligação de saturação adequadamente moldada. Este processo requer tentativa e erro no desenvolvimento do ensaio para rAbs individuais, mas seria então reprodutível uma vez estabelecido. O KD calculado pode ser usado como uma métrica de imunoreatividade como critério para avançar com aplicações de imagem ou terapia, ou para refinar a reação de conjugação anticorpo-quelato.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm conflitos de interesse.
Acknowledgments
Os autores agradecem à 3D Imaging pela produção de [89Zr]Zr-oxalate e Dr. Sheri Moores na Janssen Pharmaceuticals por fornecer anticorpos.
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P. Radioligand binding assays and their analysis. in Receptor Binding Techniques. Davenport, A. P. , Humana Press. 31-77 (2012).
- Davenport, A. P., Russell, F. D. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. Mather, S. J. , Springer. Netherlands. 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).



