Summary
Burada, radyoaktif işaretli antikorların immobilize antijenlere bağlanma afinitesini (KD) belirlemek için bir yöntem açıklanmaktadır. KD , radyoaktif etiketli bir antikorun antijenine çeşitli konsantrasyonlarda toplam, spesifik ve spesifik olmayan bağlanmasını ölçerek bir doygunluk bağlama deneyinden belirlenebilen denge ayrışma sabitidir.
Abstract
Bağlanma afinitesinin (KD) belirlenmesi, radyoaktif olarak etiketlenmiş antikorların (rAb) karakterizasyonunun önemli bir yönüdür. Tipik olarak, bağlanma afinitesi denge ayrışma sabiti KD ile temsil edilir ve antikor bağlanma bölgelerinin yarısının dengede işgal edildiği antikor konsantrasyonu olarak hesaplanabilir. Bu yöntem, radyoaktif olarak etiketlenmiş herhangi bir antikor veya diğer protein ve peptit iskelelerine genelleştirilebilir. Hücre bazlı yöntemlerin aksine, immobilize antijenlerin seçimi, antikorların uzun süreli depolanmasından sonra bağlanma afinitelerini doğrulamak, bispesifik antikor yapılarındaki fragman antijen bağlayıcı bölge (Fab) kollarının bağlanma afinitelerini ayırt etmek ve farklı hücre hatları arasında antijen ekspresyonunda değişkenlik olup olmadığını belirlemek için özellikle yararlıdır. Bu yöntem, kırılabilir 96 delikli bir plaka üzerinde belirtilen kuyucuklara sabit miktarda antijenin hareketsiz hale getirilmesini içerir. Daha sonra sığır serum albümini (BSA) ile tüm kuyucuklarda nonspesifik bağlanma engellendi. Daha sonra, rAb tüm kuyucuklara bir konsantrasyon gradyanında eklendi. rAb'nin doygunluğa ulaşmasına izin vermek için bir dizi konsantrasyon seçildi, yani tüm antijenlerin sürekli olarak rAb tarafından bağlandığı bir antikor konsantrasyonu. İmmobilize antijeni olmayan belirlenmiş kuyularda, rAb'nin spesifik olmayan bağlanması belirlenebilir. İmmobilize antijenli kuyucuklardaki toplam bağlanmadan spesifik olmayan bağlanma çıkarılarak, rAb'nin antijene spesifik bağlanması belirlenebilir. rAb'nin KD'si , ortaya çıkan doygunluk bağlama eğrisinden hesaplandı. Örnek olarak, bağlanma afinitesi, epidermal büyüme faktörü reseptörü (EGFR) ve sitoplazmik mezenkimal epitel geçişi (cMET) proteinleri için bispesifik bir antikor olan radyoişaretli amivantamab kullanılarak belirlendi.
Introduction
Radyoaktif olarak etiketlenmiş antikorların (rAb) tıpta çeşitli kullanımları vardır. Onkolojide çoğunluğu görüntüleme ve terapötik ajanlar olarak kullanılırken, romatolojiye bağlı inflamasyon, kardiyoloji ve nöroloji için görüntüleme uygulamalarıvardır 1. Görüntüleme rAbs, lezyonları saptamak için yüksek duyarlılığa sahiptir ve tedavi için hasta seçiminde yardımcı olma potansiyeline sahiptir 2,3,4,5. Ayrıca kendi antijenleri için özgüllükleri nedeniyle tedavi için de kullanılırlar. Teranostik olarak bilinen bir stratejide, aynı rAb hem görüntüleme hem de tedavi için kullanılır6.
İdeal olarak, radyoetiketleme için seçilen antikor, radyo-etiketli olmayan yöntemler kullanılarak yüksek bağlanma afinitesine ve özgüllüğüne sahip olduğu zaten kanıtlanmış bir antikordur. Antikorların radyo-etiketlenmesi, antikorların kararlı kovalent bağlar (örneğin radyoiyot) oluşturan bir radyonüklid ile doğrudan kimyasal modifikasyonu yoluyla veya dolaylı olarak daha sonra radyometallere koordine olan şelatörlerle konjugasyon yoluyla sağlanabilir 7,8. Radyoiyot gibi doğrudan radyoetiketleme, antikor üzerindeki tirozin ve histidin kalıntılarını spesifik olarak değiştirir. Bu kalıntılar antijen bağlanması için önemliyse, bu radyokonjugasyon bağlanma afinitesini değiştirecektir. Tersine, antikorların konjugasyonu ve dolaylı radyo-etiketlenmesi için birden fazla yerleşik protokol vardır. Örneğin, antikorların PET görüntülemesi için zirkonyum-89'u (89Zr) bağlamak için kullanılan yaygın bir şelatör, 9,10 antikorunun lizin kalıntılarına rastgele konjuge edilen p-izotiyosiyanatobenzil-desferiksamin (DFO) 'dir. Antijen bağlayıcı bölgede lizin kalıntıları varsa, bu bölgelerdeki konjugasyon sterik olarak antijen bağlanmasını engelleyebilir ve bu nedenle antikor-antijen bağlanmasını tehlikeye atabilir. Bu nedenle, antikorların dolaylı veya doğrudan radyoetiketlenmesi için kullanılan farklı radyokonjugasyon yöntemleri, antikor radyokonjugatının antijenine bağlanma yeteneği olarak tanımlanan immünoreaktiviteyi potansiyel olarak etkileyebilir 7,11. Bölgeye özgü konjugasyon yöntemleri bu sınırlamayı aşabilir, ancak bu teknikler ek sistein kalıntılarını veya karbonhidrat kalıntıları üzerindeki enzimatik reaksiyonlarda uzmanlığı 12,13,14,15,16 dahil etmek için antikor mühendisliği gerektirir. Bir antikor radyo-etiketlendikten sonra, rAb'nin karakterizasyonunun bir parçası olarak immünoreaktivitenin korunup korunmadığını test etmek önemlidir. İmmünoreaktiviteyi ölçmenin bir yolu, rAb'nin bağlanma afinitesini belirlemektir.
Bu protokolün amacı, rAb-antijen bağlanmasını ölçmek için kurulmuş bir radyoligand doygunluk testi kullanarak rAbs için bağlanma afinitesini belirleme sürecini tanımlamaktır. Bağlanma eğilimi Şekil 1'de özetlenmiştir. Sabit miktarda immobilize antijene daha fazla rAb eklendikçe antijene bağlı antijen miktarı artacaktır. Tüm antijen bağlanma bölgeleri doygun hale getirildikten sonra, bir platoya ulaşılacak ve daha fazla rAbs eklenmesinin bağlı antijen miktarı üzerinde hiçbir etkisi olmayacaktır. Bu modelde, denge ayrışma sabiti (KD), antijen reseptörlerinin yarısını kaplayan antikor konsantrasyonudur17. KD, bir antikorun hedefine ne kadar iyi bağlandığını ve daha yüksek bir bağlanma afinitesine karşılık gelen daha düşük bir KD ile temsil eder. Daha önce ideal bir rAb'nin 1 nanomolar veya daha az18 KD'ye sahip olması gerektiği bildirilmişti. Bununla birlikte, düşük nanomolar aralıkta KD ile daha yeni rAb'ler geliştirilmiştir ve noninvaziv görüntüleme uygulamaları için uygun olduğu düşünülmektedir 19,20,21,22. rAbs'nin radyoligand doygunluk testinde belirlenebilen bir diğer parametre, maksimum antijen bağlanma miktarına karşılık gelen Bmax'tır. Bmax, gerekirse antijen moleküllerinin sayısını hesaplamak için kullanılabilir.

Resim 1: Temsili doygunluk bağlama eğrisi. Antijene bağlı yüzdesi, sabit miktarda antijene eklenen artan antikor konsantrasyonlarına karşı çizilir. Pop-out'lar çeşitli noktalarda bağlanmayı gösterir. Sırasıyla KD ve Bmax'e karşılık gelen konsantrasyon ve bağlanma gösterilmiştir. Bu figür BioRender.com ile yaratılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bu tahlil, radyoaktif etiketli bispesifik antikor yapılarının, radyoaktif işaretli bispesifik antikorun kendi antijenlerine bağlanan her bir fragman antijen bağlayıcı bölgesi (Fab) için KD'yi belirlemesi için özellikle önemlidir. Bu protokol, her bir Fab kolunun KD'sini immobilize antijenler üzerinde ayrı ayrı belirlemek için kullanılabilir ve radyokonjugasyondan sonra her bir Fab kolunun kendi antijenine bağlanma afinitesinin etkilenip etkilenmediğini bağımsız olarak karakterize eder. Bu protokol, epidermal büyüme faktörü reseptörü (EGFR) ve sitoplazmik mezenkimal epitelyal geçiş (cMET) proteinleri için bispesifik bir antikor olan radyoaktif işaretli amivantamabın kullanımıile gösterilmiştir 19. Bir Fab kolunun EGFR (α-EGFR) veya cMET'e (α-cMET) bağlandığı ve diğer Fab kolunun bir izotip kontrolü olduğu radyoaktif etiketli tek kollu antikorlar da örnek olarak kullanılmıştır19. Bu protokol, immobilize edilebilen bilinen bir antijene sahip herhangi bir radyoaktif etiketli antikor için de uygundur. Bu protokolde, rAb'nin her bir Fab kolu için spesifik olarak belirlenmiş kuyucuklarda sabit miktarda immobilize antijene rAb'nin seyreltme serisi eklenir. rAb ayrıca, spesifik olmayan bağlanmayı belirlemek için antijen olmadan sadece sığır serum albümini (BSA) ile bloke edilmiş kuyucuklara da eklenir. Spesifik bağlanmayı belirlemek için, immobilize antijene spesifik olmayan bağlanma, toplam rAb bağlanmasından çıkarılır. Elde edilen doygunluk bağlama eğrisi daha sonra yukarıda açıklandığı gibi KD'yi belirlemek için kullanılır.
Bu yöntemin bir avantajı, saflaştırılmış antijenler kullanıldığında, antijen ekspresyon seviyelerinin hücre kültürü sırasında etkilenebileceği ve farklı hücre hatlarının değişken antijen ekspresyon seviyelerine sahip olduğu göz önüne alındığında, antijenlerin kaynağı olarak hücre hatlarının kullanılmasına kıyasla daha yüksek tekrarlanabilirliktir. Radyoaktif etiketli bispesifik antikorlar söz konusu olduğunda, antijenlerden sadece birini diğeri olmadan eksprese eden hücre hatları mevcut olmayabilir, bu da bireysel Fab kollarının bağlanma afinitesini karakterize etmeyi çok zorlaştırır. Özellikle, radyoligand doygunluk testi yönteminin radyoaktif etiketli olmayan yöntemlere göre en önemli avantajı, rAb'nin konjuge edilmemiş fraksiyonunun katkısı olmadan rAb'nin bağlanma afinitesinin spesifik karakterizasyonudur. Yazarların bilgisinin en iyisine göre, şu anda rAb'yi ana konjuge edilmemiş antikorundan ayırmak için herhangi bir saflaştırma tekniği yoktur. Şelatör ve radyonüklidin nispeten küçük boyutu göz önüne alındığında, rAb'nin genel moleküler ağırlığına katkıları, boyut dışlama kromatografisinde önemsizdir. Bu nedenle, herhangi bir radyoetiketleme tekniğinden üretilen ürün hemen hemen her zaman rAb ve ana konjuge edilmemiş antikorun bir karışımıdır. Radyoetiketli doygunluk testi kullanılarak bağlanma afinitesinin karakterize edilmesi, test edilen ürünün yalnızca rAb olmasını sağlar.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOT: Protokolün grafiksel bir gösterimi için Şekil 2'ye bakın.

Şekil 2: Protokolün şeması. Satır ve sütun etiketleri, kırılabilir 96 delikli plakayı ayarlamak için bir kılavuz olarak gösterilir. Beklenen bağlanma, antijen ve BSA için iyi bir örnekte gösterilmiştir. Kavisli ok, yalnızca BSA ile kuyulardan yıkanması beklenen rAb'yi belirtir. Bu figür BioRender.com ile yaratılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. Tampon hazırlama
- 50 mL immobilizasyon tamponu hazırlayın (50 mM Na2 CO 3'lüksulu çözelti; pH = 9.0).
- Tartım kağıdına 191 mg NaHCO 3 ve 23,9 mg Na2CO3 tartın ve 50 mL'lik bir konik tüpe aktarın. Çözünmesi için 40 mL 18 MΩ su ve vorteks ekleyin. Toplam hacmi 18 MΩ su ile 50 mL'ye getirmeden önce gerekirse pH'ı 9,0'a ayarlayın.
- 250 mL'lik bir şişeye 200 mL PBS ve ardından 100 μL Ara-20 ekleyerek yaklaşık 200 mL yıkama tamponu (% 0.05 Tween-20 içeren fosfat tamponlu salin (PBS)) hazırlayın.
- 50 mL bağlayıcı tampon hazırlayın (%0.05 Ara-20 ve %0.1 sığır serum albümini (BSA) içeren PBS).
- Tartım kağıdına 50 mg BSA tartın ve 50 mL'lik konik bir tüpe aktarın. Tüpe 50 mL PBS ve ardından 25 μL Ara-20 ekleyin. Karıştırmak için yavaşça girdap.
- 50 mL blokaj tamponu hazırlayın (PBS'de %3 BSA).
- Tartım kağıdına 1,5 g BSA tartın ve 50 mL'lik konik bir tüpe aktarın. 50 mL PBS ekleyin ve karıştırmak için yavaşça girdap yapın.
NOT: En iyi sonuç için tüm tamponların 4 °C'de 1 haftaya kadar saklanması önerilir.
- Tartım kağıdına 1,5 g BSA tartın ve 50 mL'lik konik bir tüpe aktarın. 50 mL PBS ekleyin ve karıştırmak için yavaşça girdap yapın.
2. Antijen immobilizasyonu
- Antijeni immobilizasyon tamponunda seyrelterek 5 μg/mL konsantrasyona ulaşın.
- 8 x 3 dizide kırılabilir 96 kuyulu, düz tabanlı bir plakanın 24 kuyucuğunun dibine antijen kuyucuğu başına 100 μL ekleyin (A-H satırları için 1-3 sütunları). Plakayı sızdırmazlık bandı ile örtün.
NOT: Kuyu plakasının yüzeyinin, karışık hidrofobik ve hidrofilik alanların adsorpsiyonunu en üst düzeye çıkarmak için işlendiğinden emin olun. Bu ön işlem görmüş plakalar ticari olarak temin edilebilir. - Gece boyunca 4 ° C'de inkübe edin.
- Ertesi gün, plakayı 3x yıkama tamponu ile yıkayın.
- Sıvıyı atmak için plakayı lavaboda hızlı bir şekilde ters çevirin ve fazla sıvıyı çıkarmak için plakayı bir kağıt havlu yığınına dokunun.
- Çok kanallı pipet kullanarak, antijeni içeren kuyucuklara yıkama tamponu kuyucuğu başına 300 μL ilave edin. Sıvıyı 2.4.1'de açıklandığı gibi çıkarın. Yıkama adımını toplam üç kez tekrarlayın.
3. BSA ile spesifik olmayan sitelerin engellenmesi
- Çok kanallı pipet kullanarak, 96 delikli plakanın 24 antijen kaplı kuyucuğuna ve 24 boş kuyucuğuna (A-H sıraları için sütun 1-6) blokaj tamponu kuyucuğu başına 300 μL ekleyin.
- Plakayı ortam sıcaklığında 1 saat boyunca inkübe edin.
- Plakayı yıkama tamponu kuyusu başına 300 μL ile toplam üç kez yıkayın. Plakanın yıkanmasının ayrıntılı bir açıklaması için adım 2.4'e bakın.
4. Seri seyreltmeler ve rAb çözeltisinin eklenmesi
DİKKAT: Aşağıdaki adımlar radyoaktiviteyi içerir. Adımlar sadece radyasyon güvenliği eğitimi almış kişiler tarafından gerçekleştirilmelidir. Araştırmacılar eldiveni iki katına çıkarmalı ve yeterli kalkanla adımlar atmalıdır.
- Seçim yöntemini kullanarak incelenen rAb'yi sentezleyin. Örnek olarak kullanılan rAb'ler daha önce açıklandığı gibi sentezlendi19.
NOT: Bu protokol, radyo-etiketli bir rAb'nin karakterizasyonuna odaklanır. - Bağlayıcı tamponda rAb'nin 8 x 3 kat seri seyreltmesini (plakadaki A-H sıraları için belirlenmiş) yapın.
NOT: Seri seyreltmelerin konsantrasyonları her rAb için değişecektir. Ayrıntılar Tartışma bölümünde ele alınmıştır. Seyreltme faktörü değişirse, her seyreltme için gereken hacim, 1) her bir kuyucukta rAb'nin bağlanması, 2) aşağıdaki seyreltmenin tohumlanması ve 3) her bir kuyucuğa eklenen toplam rAb'nin radyoaktivitesini ölçmek için gama sayımı için rAb standart bir çözeltinin alıntılanması için yeterli hacim sağlamak üzere yeniden hesaplanmalıdır.- İlk konsantrasyonun 1,2 mL'lik bir çözeltisini yapmak için gereken stok rAb hacmini hesaplayın (A olarak etiketleyin).
- B, C, D, ... için H. Bağlanma tamponunun 4.2.1. adımında hesaplanan hacim eksi 1,2 mL'yi A etiketli bir mikrosantrifüj tüpüne ekleyin.
- 4.2.1 olarak hesaplanan stok rAb hacmini A tüpüne ekleyin. Vorteksi yavaşça karıştırın ve ardından tüpün altındaki tüm sıvıyı toplamak için mini bir mikro santrifüj kullanarak aşağı doğru döndürün.
- A tüpünden B tüpüne 400 μL ekleyin. Mini bir mikrosantrifüj kullanarak karıştırmak ve daha sonra döndürmek için vorteks. B'den C'ye, C'den D'ye, ..., G'den H'ye eklemeyi tekrarlayın.
- Her seyreltmenin kuyucuğu başına 100 μL'yi, antijenle hareketsiz hale getirilmiş üç kuyucuğa ve sadece BSA ile bloke edilmiş üç kuyucuğa ekleyin. Örneğin, A1-A3 (antijen) ve A4-A6 (BSA) kuyularına seyreltme A ekleyin.
- Her seyreltmenin 100 μL'sini A std - H std etiketli mikrosantrifüj tüplerine ekleyin. Bu tüpleri gama sayacında test edilmek üzere rAb standartları olarak saklayın.
- Plakayı 37 ° C'de 1 saat boyunca hafifçe sallayarak inkübe edin.
5. Yıkama plakaları ve tahlil radyoaktivitesi
- Her kuyucuk için mikrosantrifüj tüplerini etiketleyin (A1 ila A6, B1 ila B6 ... H1-H6 aracılığıyla). İstenirse numuneleri renk kodlamak için iki farklı renkli işaretleyici kullanın; biri antijenle kaplanmış kuyular için, diğeri ise yalnızca BSA'lı kuyular için.
- Bir vakum aspiratörü kullanarak rAb'yi her kuyucuktan aspire edin.
- Çok kanallı pipet kullanarak her bir kuyucuğa 300 μL yıkama tamponu ekleyin. Yıkama tamponunu aspire edin. Yıkamayı toplam beş kez tekrarlayın.
- Kuyucukları uygun mikrosantrifüj tüplerine ayırın.
- Bir gama sayacı kullanarak tüplerdeki radyoaktiviteyi sayın. Önce antijenli tüpleri (H1, H2, H3 ila A1, A2, A3) ve sonra sadece BSA'lı tüpleri (H4, H5, H6 ila A4, A5, A6) sayın. Paraziti en aza indirmek için, her seyreltmenin standartlarını (H std'den A std'ye) farklı bir zamanda ayrı ayrı sayın.
6. Veri analizi
NOT: Ek dosyalar, verileri analiz etmek ve çizmek için ilgili elektronik tabloyu ve istatistiksel analiz şablonlarını içerir.
- Bir elektronik tabloda, her örnek için toplam, özel ve spesifik olmayan bağlamayı hesaplayın (ek dosya olarak eklenen elektronik tablo şablonuna bakın).
- "Bağlı Etkinlik"i, numunenin (gama sayacından elde edilen) dakika başına sayımlarının (BGBM) uygun standardın BGBM'sine bölünmesiyle hesaplayın. "% Bound"u Bağlı Etkinlik çarpıları 100 olarak hesaplayın.
- "Toplam Bağlı, mol/L"yi "% Bağlı" ile rAb eklenmiş konsantrasyonu (mol/L) ile çarparak hesaplayın. "Toplam Bağlı, mol/L"yi litre (0,0001 L) cinsinden eklenen rAb hacmiyle çarparak "Toplam Bağlı, mol" değerini hesaplayın.
- BSA seyreltilerinin "Toplam Bağlı, mol" ü antijen seyreltilerinden çıkararak "Spesifik Bağlanma, mol" ü hesaplayın, böylece A1 A4 ile, A2 A5 ile, A6 ile A3, B1 B4 vb.
- Her bir kuyucuk için "Toplam Bağlama, mol" den "Özel Bağlama, mol" çıkararak "Spesifik Olmayan Bağlama, mol" ü hesaplayın.
- İstatistiksel analiz çizim yazılımında, x ekseninde eklenen rAb (nmol / L) konsantrasyonunu y ekseninde bağlama (mol) ile grafiğini çizin. Üçlü toplam bağlama, belirli bağlama ve özgül olmayan bağlama içinde çizim yapmak için ayrı gruplar oluşturun. Kullanılan yazılımda aşağıdaki parametreleri seçerek doğrusal olmayan bir uyum analizi gerçekleştirin (Malzeme Tablosu; ek dosya olarak ekteki istatistiksel analiz şablonuna bakın).
- Yeni Analiz'i seçin. XY analizleri altında, Doğrusal olmayan regresyon (eğri uyumu) seçeneğini belirleyin. Hangi veri kümelerini analiz et? altında tüm verilerin seçili olduğundan emin olun ve ardından Tamam'ı seçin.
- Model sekmesinde, Bağlama - Doygunluk altında, Bir site - Belirli bağlama'yı seçin. Güven sekmesinde, 'belirsiz' uyumları tanımla'yı seçin. Diğer tüm parametreleri varsayılan olarak bırakın ve Tamam'ı seçin.
NOT: Bu, toplam, spesifik ve spesifik olmayan bağlama için KD ve Bmax'ı hesaplar. Spesifik bağlanmanın K D'si, antijene bağlı rAb'nin nmol / L'sindeki KD'dir.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Bu yöntem, sabit miktarda immobilize antijene farklı konsantrasyonlarda rAb eklendiği doygunluk bağlama testine dayanarak bir rAb için bağlanma afinitesini (KD) hesaplar. Bağlanma eğrisi, başlangıçta dik olduğu logaritmik büyümeyi takip etmeli ve daha sonra antijen doygun hale geldikçe platolar oluşturmalıdır. BelirlenenK D'nin doğru olduğundan emin olmak için, rAb konsantrasyonları doygunluğa ulaşacak kadar yüksek olmalıdır. Bu test için, radyoaktif etiketli antikorlar DFO'ya konjuge edildi ve daha önce tarif edildiği gibi 89Zr ile radyo-etiketlendi19. Şekil 3, temsili doygunluk bağlama grafiklerini göstermektedir. Epidermal büyüme faktörü reseptörü (EGFR) ve sitoplazmik mezenkimal epitel geçişi (cMET) proteini için bispesifik bir antikor olan radyoaktif işaretli amivantamab, EGFR (Şekil 3A) ve cMET (Şekil 3B) proteinlerine bağlandı19. Doygunluk bağlama grafikleri, EGFR (Şekil 3C) ve cMET (Şekil 3D) proteinlerine bağlı tek kollu radyoetiketli Fabs 19 için de gösterilmiştir. Tüm alt şekillerde, doğrusal olmayan regresyon eğrileri, eğrilerden minimum aykırı değerlerle seyreltme serisini temsil ediyordu. Spesifik bağlama, toplam bağlamanın çoğuna karşılık geliyordu. Spesifik olmayan bağlanma genel olarak düşük olsa da, daha yüksek rAb konsantrasyonları daha fazla spesifik olmayan bağlanma gösterdi ve bu da bu tahlilde spesifik olmayan bağlanma için olası bir eşiği gösterdi. rAb'lerin bağlanma afiniteleri beklenen nanomolar aralıktaydı. Tek kollu ±-EGFR ve ±-cMET için sırasıyla 8.4 α 1.7 nM ve 4.2 α 1.5 nM KD değerleri, hedef antijen için, sırasıyla 9.9 ± 2.1 nM ve 16.9 ± 5.9 nM KD değerlerine sahip bispesifik rAb ile benzer bir afinite göstermektedir.
Radyo-etiketli α-cMET'in immobilize cMET proteinlerine bağlanması için yetersiz deneyler, optimizasyon gerektiren parametrelerin sonuçlarını göstermek için Şekil 4'te gösterilmiştir. Şekil 4A'da, eklenen rAb'nin konsantrasyon aralığı çok düşüktü ve bağlanma eğrisinin bir platoya ulaşmamasıyla gösterildiği gibi doygunluğa ulaşılamadı. Bu koşullar, bağlı rAb'ye karşı eklenen rAb konsantrasyonunun doğrusal bir grafiği ile sonuçlandı. Veriler doğrusal olmayan regresyon modeline uymadığından, istatistiksel analizde KD değerinin "belirsiz" olduğu belirlenmiştir. Şekil 4B'de, radyo-etiketli α-cMET için çok yüksek konsantrasyonlar kullanılmıştır. Doygunluğa, bağlanma eğrisinin yatay platosu ile gösterildiği gibi ulaşıldı. Bununla birlikte, spesifik olmayan bağlanma, toplam bağlamaya belirgin bir şekilde katkıda bulunur. Bu koşullar, 4,8 - 44,2 nM'lik büyük bir %95 güven aralığına sahip 14,9 nM'lik bir KD değeri ile gösterilen yüksek miktarda belirsizliğe neden olur. Bu nedenle, Şekil 3D'de gösterildiği gibi, eklenen rAb'nin konsantrasyon aralığını optimize etmek, daha doğru KD değerleri sağlayacaktır. Doygunluk bağlama eğrisi, reaksiyon kinetik için Michaelis-Menten denklemine dayanmaktadır. Bir eğri, noktalar regresyon çizgisi17'nin etrafına rastgele dağıtıldığında iyi bir uyumdur. Dar bir güven aralığı, KD değerinin doğru olduğunu gösterir.

Şekil 3: KD'yi belirlemek için doygunluk bağlama grafikleri. [89Zr]Zr-DFO-amivantamab'ın (A) EGFR ve (B) cMET proteinlerine, (C) [89 Zr]Zr-DFO-α-EGFR'nin EGFR proteinine ve (D) [89Zr]Zr-DFO-α-cMET'in bağlanma afinitesini hesaplamak için cMET proteinlerine bağlanma eğrileri. Hata çubukları, her konsantrasyon için bağlı 89Zr etiketli antikorun standart sapmasını temsil eder. KD ve Bmax'in ortalama ± SD'si, her koşul için üç bağımsız deneyden gösterilmiştir. Bu rakam Cavaliere et al19'un izniyle yeniden kullanılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
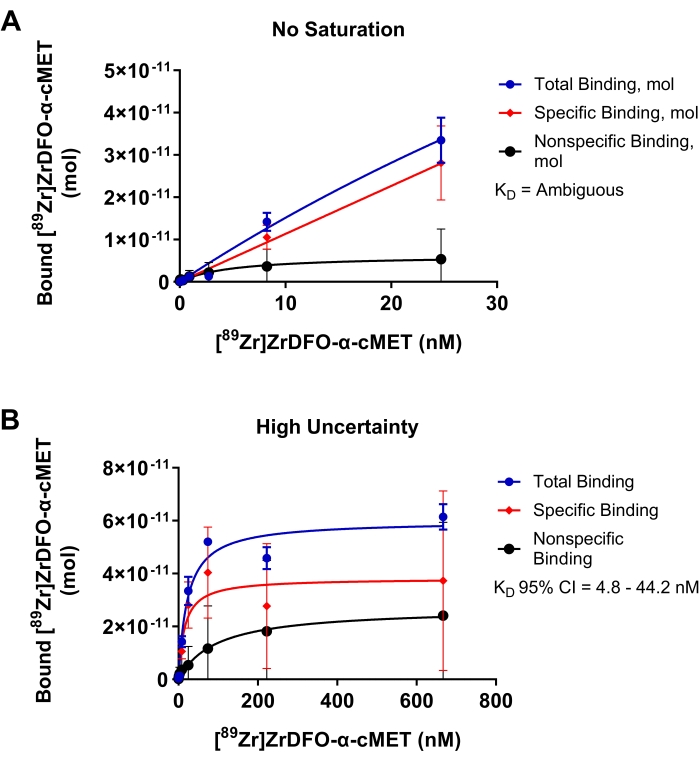
Şekil 4: K D'nin doğru bir şekilde belirlenemediği doygunluk bağlama grafikleri. [89Zr]Zr-DFO-α-cMET'in cMET proteinlerine bağlanması. Hata çubukları, bağlı [89Zr]Zr-DFO-α-cMET'in standart sapmasını temsil eder. (A) [89Zr]Zr-DFO-α-cMET konsantrasyonları çok düşüktür ve doygunluğa ulaşılamamıştır. Eğri doğrusal olduğundan ve doğrusal olmayan regresyon modeline uymadığından KD hesaplanamaz. (B) Spesifik bağlama için yüksek belirsizlik, KD (4,8-44,2 nM) için geniş% 95 güven aralığı (CI) ile gösterilir. Yüksek rAb konsantrasyonları nedeniyle yüksek spesifik olmayan bağlanma da vardır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Dosyalar. Bu Dosyayı indirmek için lütfen tıklayınız.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
rAbs'nin geliştirilmesinin bir parçası olarak, bir rAb'nin hedefine özellikle yüksek bağlanma afinitesi ile bağlanmasını sağlamak önemlidir. Bağlanma afinitesinin belirlenmesi, rAb'nin immünoreaktivitesinin, immobilize antijen kullanılarak radyoligand doygunluk testi yoluyla radyokonjugasyondan etkilenip etkilenmediğini bildirebilir. BSA'ya rAb bağlanmasının belirlenmesi, immobilize antijene spesifik bağlanmayı daha doğru bir şekilde ölçmek için spesifik olmayan bağlanmayı ölçmek için kullanılabilir. Bu yöntem, KD'yi hesaplamak ve bağlanma afinitesini belirlemek için bir doygunluk bağlama eğrisi oluşturmak üzere farklı rAb konsantrasyonlarının bağlanmasını test eder.
Bu testi yapmak için, araştırılan rAb için antijene sahip olmak gerekir. Antijenin, antikorun bağlandığı epitopa sahip olması gerekir. Yeni antikorların bilinmeyen bağlanma epitoplarına sahip olduğu durumlarda, bağlanma afinitesini belirlemek için radyo-etiketsiz yöntemler daha uygun olabilir. Deneye başlamadan önce, bir literatür taraması önerilir. Daha önce ELISA bazlı testlerde kullanılmış olan ilgi çekici antijenlerin bu tahlil için etkili olması muhtemeldir.
Radyonüklidin yarı ömrüne ve gama sayacının duyarlılığına bağlı olarak, standartların gama sayacının nicel sınırları içinde olan bir radyoaktivite seviyesine bozunması zaman alabilir. Radyoaktivite seviyesinin gama sayacı için çok yüksek olması bekleniyorsa, standart örnekleri seyreltin ve ardından veri analizinde seyreltme faktörü ile çarpın. Bu adım, homojen olmayan standart çözeltilere ve yanlış okumaya neden olabilecek antikor agregasyonu veya bozunması olasılığını önlemek için deney gününde yapılmalıdır.
Uygun şekilde şekillendirilmiş bir doygunluk eğrisi oluşturmak, seçilen seyreltme serisine dayanır. Bu işlem deneme yanılma gerektirecektir. rAbs konsantrasyonlarını genelleştirememe, protokolün bir sınırlamasıdır, çünkü tüm rAb'lerin antijenleri için farklı bağlanma afinitelerine sahip olması beklenir. Bu protokol her rAb için optimize edilmelidir. Optimize edildikten sonra, protokol belirli rAb için yeniden üretilebilir olmalıdır. Hem konsantrasyon aralığının hem de seyreltme faktörünün, eğrinin şekline göre ayarlanması gerekebilir. Antikor bağlanması için beklenen nanomolar aralık göz önüne alındığında, bu aralığın mümkün olan en geniş temsili ile başlamak, gelecekteki çalışmalar için daha dar bir konsantrasyon aralığına yakınlaştırılmasına izin verecektir. Sekiz seri seyreltme yerine, on altısı bağlama aralığını anlamak için daha fazla veri noktası sağlayacaktır. Konjuge olmayan antikorun KD'si biliniyorsa, çalışmayı ilk tasarlarken bu değerin aralığın orta konsantrasyonu olarak kullanılması önerilir. Malzemelerin mevcudiyetine bağlı olarak, farklı konsantrasyon aralıklarına ve seyreltme faktörlerine sahip birden fazla devam eden denemeye sahip olmak, protokolü nispeten daha hızlı optimize edebilir. Kuluçka süresi, doygunluğa ulaşılmasını sağlamak için ayarlanabilir. Ek olarak, bağlanma doygunlukta bile düşükse, KD'yi doğru bir şekilde hesaplamak için yeterli sinyal aralığı olmayabilir. İmmobilize antijen konsantrasyonunun optimize edilmesi gerekebilir. Maksimum bağlanma sinyalini belirlemek için farklı konsantrasyonlarda immobilize antijen ve rAb stok konsantrasyonu ile bir ön çalışma yapılabilir.
Radyoligand doygunluk testi yerleşik bir yöntemdir ve rAbs'nin bağlanma afinitesini belirlemek için akış sitometrisi veya yüzey plazmon rezonansı (SPR) gibi diğer radyo-etiketli olmayan yöntemlerle karşılaştırıldığında birçok faydası vardır. Radyoaktif etiketli olmayan antikorların tespitini kullanan yöntemler, hem konjuge hem de konjuge olmayan antikorlardan oluşan karışık bir numunenin bağlanma afinitesini belirler. Radyoligand doygunluk testinde, kaydedilen tek sinyal, biyomedikal uygulamayı etkileyecek radyoaktif etiketli türler için daha doğru bir KD sağlayan radyoişaretli antikor konjugatıdır. Bu düşünce, radyoligand doygunluk tahlilinden elde edilen sonuçları ve radyo-etiketli olmayan tekniklerden elde edilen sonuçları, farklı örnekleri ölçtükleri için pratik olarak karşılaştırılamaz hale getirir - rAb vs rAb artı ebeveyn antikoru. Bir çalışma, radyo-etiketli olmayan antikor-şelatör konjugatının bağlanma afinitesini ve immobilize proteinler üzerinde SPR kullanan ebeveyn bispesifik antikorunu karşılaştırdı. Antikor-şelatör konjugatının KD değerleri ile ebeveyn antikoru arasında beş kat fark vardı. SPR ile çoklu hücre hatlarındaki doygunluk testi arasında bulunan KD değerlerindeki fark, 10 ila 1.000 kat23 arasında değişmiştir. Radyoaktif etiketli olmayan antikor-şelatör, konjuge ve konjuge olmayan antikorların bir karışımıdır, doygunluk testi tarafından belirlenen KD değerleri sadece radyoaktif etiketli konjuge antikordan elde edilir. Kullanılan hücre hatları arasında antijen ekspresyonunda da farklılıklar vardır. Bu nedenle, radyoligand doygunluk testini doğrulamak için radyo-etiketsiz teknikler kullanılamaz. Bununla birlikte, rAb'nin KD'si belirlendikten sonra, antikorun ebeveyn ve konjuge varyantları arasındaki bağlanmadaki farklılıkları belirlemek için rekabetçi bir bağlanma testi yapılabilir17,21.
Radyoligand doygunluk testi, rAb'nin immobilize antijen yerine hücrelere doygunluk bağlanmasını belirlemek için genişletilebilir. Aynı kavramları kullanarak, sabit sayıda hücreye farklı konsantrasyonlarda rAb eklenebilir. Protokolde özetlenen veri analizi daha sonra rAb'nin hücrelere bağlanma afinitesini belirlemek için kullanılabilir, bu da ilgilenilen hücre hattında bulunan antijen moleküllerinin sayısını hesaplamak için Bmax'ı belirler. Bu yöntem ayrıca, hedeflerine spesifik bağlanmalarını belirlemek için diğer radyoaktif etiketli protein ve peptit iskelelerine genelleştirilebilir. Sonuç olarak, bu protokol rAbs'nin immobilize protein antijenlerine bağlanma afinitesini belirleme sürecini açıklamaktadır. Proses, immobilize antijene eklemek üzere rAb'nin seri seyreltilmesini sağlamak için temel laboratuvar tekniklerini kullanır. En zorlu yön, uygun şekilde şekillendirilmiş bir doygunluk bağlama eğrisi oluşturmak için rAb konsantrasyonlarını belirlemektir. Bu süreç, bireysel rAb'ler için tahlilin geliştirilmesinde deneme yanılma gerektirir, ancak bir kez kurulduktan sonra tekrarlanabilir. Hesaplanan KD , görüntüleme veya terapi uygulamalarında ilerlemek veya antikor-şelat konjugasyon reaksiyonunu hassaslaştırmak için bir kriter olarak immünoreaktivite metriği olarak kullanılabilir.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarların çıkar çatışması yoktur.
Acknowledgments
Yazarlar, [89Zr] Zr-oksalat üretimi için 3D Görüntüleme'ye ve Janssen Pharmaceuticals'taki Dr. Sheri Moores'a antikor sağladıkları için teşekkür ediyor.
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P. Radioligand binding assays and their analysis. in Receptor Binding Techniques. Davenport, A. P. , Humana Press. 31-77 (2012).
- Davenport, A. P., Russell, F. D. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. Mather, S. J. , Springer. Netherlands. 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).



