Summary
在这里,描述了一种确定放射性标记抗体与固定化抗原的结合亲和力(KD)的方法。KD 是平衡解离常数,可以通过测量放射性标记抗体在不同浓度下与其抗原的总,特异性和非特异性结合来确定饱和结合实验。
Abstract
确定结合亲和力(KD)是放射性标记抗体(rAb)表征的一个重要方面。通常,结合亲和力由平衡解离常数KD表示,并且可以计算为抗体的浓度,其中一半抗体结合位点在平衡时被占据。该方法可推广到任何放射性标记的抗体或其它蛋白质和肽支架。与基于细胞的方法相比,固定化抗原的选择对于验证抗体长期储存后的结合亲和力,区分双特异性抗体构建体中片段抗原结合区(Fab)臂的结合亲和力以及确定不同细胞系之间抗原表达是否存在变异性特别有用。该方法涉及将固定量的抗原固定到可破碎的96孔板上的指定孔中。然后,用牛血清白蛋白(BSA)在所有孔中阻断非特异性结合。随后,将rAb以浓度梯度添加到所有孔中。选择一系列浓度以使rAb达到饱和,即所有抗原都由rAb连续结合的抗体浓度。在没有固定抗原的指定孔中,可以确定rAb的非特异性结合。通过从孔中与固定抗原的总结合中减去非特异性结合,可以确定rAb与抗原的特异性结合。根据得到的饱和结合曲线计算rAb的KD 。例如,使用放射性标记的amivantamab(表皮生长因子受体(EGFR)和细胞质间充质 - 上皮转化(cMET)蛋白的双特异性抗体)测定结合亲和力。
Introduction
放射性标记抗体(rAb)在医学上有多种用途。虽然大多数在肿瘤学中用作成像和治疗剂,但也有用于风湿病相关炎症,心脏病学和神经病学的成像应用1。影像学 rAbs 对检测病变具有高敏感性,并有可能帮助患者选择治疗2,3,4,5。它们也用于治疗,因为它们对各自的抗原具有特异性。在称为治疗诊断学的策略中,相同的rAb用于成像和治疗6。
理想情况下,选择用于放射性标记的抗体是一种已经证明具有使用非放射性标记方法具有高结合亲和力和特异性的抗体。抗体的放射性标记可以通过用放射性核素直接化学修饰抗体来实现,放射性核素形成稳定的共价键(例如放射性碘),或者间接通过与随后与放射性金属配位的螯合剂偶联来实现7,8。直接放射性标记如用放射性碘特异性修饰抗体上的酪氨酸和组氨酸残基。如果这些残基对抗原结合很重要,那么这种放射性结合会改变结合亲和力。相反,抗体的偶联和间接放射性标记有多种既定的方案。例如,用于结合锆-89 (89Zr)用于抗体PET成像的常用螯合剂是p-异硫氰酸苄基-去铁胺(DFO),它与抗体9,10的赖氨酸残基随机偶联。如果抗原结合区有赖氨酸残基,这些位点的偶联可能会在空间上阻碍抗原结合,从而损害抗体-抗原结合。因此,用于抗体的间接或直接放射性标记的不同放射性偶联方法可以潜在地影响免疫反应性,定义为抗体放射性偶联物与其抗原7,11结合的能力。位点特异性偶联方法可以规避这一限制,但这些技术需要抗体工程来结合额外的半胱氨酸残基或碳水化合物残基酶促反应的专业知识12,13,14,15,16。一旦抗体被放射性标记,重要的是要测试免疫反应性是否作为rAb表征的一部分保留。测量免疫反应性的一种方法是确定rAb的结合亲和力。
该协议的目的是描述使用已建立的放射性配体饱和度测定来确定rAb的结合亲和力以量化rAb-抗原结合的过程。图 1 概述了绑定趋势。随着更多的rAb加入到固定量的固定化抗原中,抗原结合的量将增加。一旦所有抗原结合位点饱和,将达到平台,并且添加更多的rAbs将对结合抗原的量没有影响。在该模型中,平衡解离常数(KD)是占据抗原受体17一半的抗体的浓度。KD表示抗体与其靶标的结合程度,较低的KD对应于较高的结合亲和力。以前报道过,理想的rAb应具有1纳摩尔或更小的18纳摩尔的KD。然而,最近的rAbs已经用KD在低纳摩尔范围内开发出来,并且被认为适用于无创成像应用19,20,21,22。在rAb的放射性配体饱和测定中可以确定的另一个参数是Bmax,它对应于抗原结合的最大量。如果需要,Bmax可用于计算抗原分子的数量。

图1:代表性饱和结合曲线。 将抗原结合的百分比与添加到固定量抗原中的抗体浓度的增加相对。弹出窗口演示了在各个点的绑定。分别显示对应于KD 和Bmax的浓度和结合。这个数字是用 BioRender.com 创建的。 请点击此处查看此图的大图。
该测定对于放射性标记的双特异性抗体构建体特别重要,以确定放射性标记的双特异性抗体与其各自抗原结合的每个片段抗原结合区(Fab)臂的KD 。该协议可用于在固定抗原上分别测定每个Fab臂的KD ,以独立表征每个Fab臂对其各自抗原的结合亲和力在放射偶联后是否受到影响。该方案通过使用放射性标记的amivantamab(一种用于表皮生长因子受体(EGFR)和细胞质间充质 - 上皮转化(cMET)蛋白的双特异性抗体19来证明。放射性标记的单臂抗体,其中一个Fab组与EGFR(α-EGFR)或cMET(α-cMET)结合,另一个Fab组是同种型对照,也被用作示例19。该方案也适用于任何具有可固定的已知抗原的放射性标记抗体。在该协议中,将一系列rAb的稀释液添加到rAb的每个Fab臂特异性指定孔中的固定化抗原中。rAb也被添加到仅被牛血清白蛋白(BSA)阻断的孔中,没有抗原,以确定非特异性结合。为了确定特异性结合,从总rAb结合中减去与固定抗原的非特异性结合。然后使用得到的饱和结合曲线来确定KD,如上所述。
与使用细胞系作为抗原来源相比,该方法的一个优点是使用纯化抗原时具有更高的再现性,因为在细胞培养过程中可能会影响抗原表达水平,并且不同的细胞系具有不同水平的抗原表达。在放射性标记的双特异性抗体的情况下,仅表达一种抗原而没有另一种抗原的细胞系可能不可用,这将使表征单个Fab臂的结合亲和力变得非常具有挑战性。值得注意的是,与非放射性标记方法相比,放射性配体饱和度测定方法的关键优势是可以特异性表征rAb的结合亲和力,而无需rAb的未结合部分的贡献。据作者所知,目前尚无纯化技术将rAb与其母体非偶联抗体分离。鉴于螯合剂和放射性核素的尺寸相对较小,它们在尺寸排阻色谱中对rAb总分子量的贡献微不足道。因此,从任何放射性标记技术产生的产物几乎总是rAb及其母体非偶联抗体的混合物。使用放射性标记的饱和度测定法表征结合亲和力可确保被测产品仅是 rAb。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注:有关协议的图形表示,请参阅 图 2 。

图 2:协议示意图。 行和柱标签指示为设置可破碎的96孔板的指南。预期结合在抗原和BSA的示例中显示。弯曲的箭头表示预计仅用BSA从孔中冲洗出来的rAb。这个数字是用 BioRender.com 创建的。 请点击此处查看此图的大图。
1. 缓冲液制备
- 制备50mL固定缓冲液(50mM Na2CO3的水溶液;pH = 9.0)。
- 在称量纸上称取 191 mg NaHCO3 和23.9 mg Na2CO 3,然后转移到 50 mL 锥形管中。加入40 mL 18 MΩ水和涡旋溶解。如果需要,将pH值调节至9.0,然后用18 MΩ水将总体积降至50 mL。
- 通过向250 mL瓶中加入200 mL PBS和100μL吐温-20来制备约200mL洗涤缓冲液(含有0.05%吐温-20的磷酸盐缓冲盐水(PBS)。
- 准备50mL结合缓冲液(PBS含有0.05%吐温-20和0.1%牛血清白蛋白(BSA))。
- 在称量纸上称量 50 mg BSA,然后转移到 50 mL 锥形管中。向试管中加入50 mL PBS,然后加入25 μL吐温-20。轻轻涡旋混合。
- 准备50mL封闭缓冲液(PBS中3%BSA)。
- 在称量纸上称量 1.5 g BSA,然后转移到 50 mL 锥形管中。加入50毫升PBS,轻轻涡旋混合。
注意:建议所有缓冲液在4°C下储存长达1周,以获得最佳效果。
- 在称量纸上称量 1.5 g BSA,然后转移到 50 mL 锥形管中。加入50毫升PBS,轻轻涡旋混合。
2. 抗原固定
- 在固定化缓冲液中稀释抗原以达到5μg/ mL的浓度。
- 将每孔抗原100μL加入8×3阵列中可破碎的96孔平底板的24孔的底部(A-H行为1-3列)。用密封胶带盖住板。
注意:确保孔板的表面已经过处理,以最大限度地吸附混合疏水性和亲水性结构域。这些预处理的板是市售的。 - 在4°C下孵育过夜。
- 第二天,用洗涤缓冲液清洗平板3次。
- 将板在水槽中快速倒置以处理液体,并将板在一堆纸巾上敲击以除去多余的液体。
- 使用多通道移液器,将每孔洗涤缓冲液加入300μL到含有抗原的孔中。按照2.4.1中所述取出液体。重复洗涤步骤总共三次。
3. 用BSA阻断非特异性位点
- 使用多通道移液器,向96孔板的24个抗原包被孔和24个空孔(A-H行为1-6列)中加入每孔300μL封闭缓冲液。
- 在环境温度下将板孵育1小时。
- 用每孔300μL洗涤缓冲液共洗涤板三次。有关清洗板的详细说明,请参阅步骤2.4。
4. 连续稀释和加入 rAb 溶液
注意:以下步骤涉及放射性。步骤只能由接受过辐射安全培训的人员执行。研究人员应加倍手套,并在充分屏蔽的情况下执行步骤。
- 使用所选方法合成正在研究的 rAb。用作示例的rAbs如前面描述的19所示进行合成。
注意:该协议侧重于无线电标记后rAb的表征。 - 在结合缓冲液中对rAb进行8×3倍连续稀释(指定用于板上的行A-H)。
注意:序列稀释液的浓度将因每种rAb而异。详细信息在讨论部分讨论。如果稀释因子发生变化,应重新计算每次稀释所需的体积,以确保足够的体积1)每个孔中rAb的结合,2)接种下一个稀释液,以及3)等分试rAb标准溶液进行伽马计数,以测量添加到每个孔中的总rAb的放射性。- 计算制造第一浓度的1.2 mL溶液所需的储备rAb的体积(标记为 A)。
- 向标记有 B, C, D,...到 H。向标有 A的微量离心管中加入1.2mL减去步骤4.2.1中计算的结合缓冲液的体积。
- 将4.2.1中计算的库存rAb的体积加入管 A。轻轻涡旋混合,然后使用迷你微量离心机向下旋转,以收集管底部的所有液体。
- 从试管 A 向试管 B中加入400μL。涡旋混合,然后使用迷你微量离心机旋转。重复从 B 到 C, C 到 D,..., G 到 H。
- 每孔每种稀释液加入100μL到三个用抗原固定的孔和三个仅用BSA封闭的孔中。例如,将稀释液 A添加到孔A1-A3 (抗原)和A4-A6(BSA)中。
- 向标有 A std - H std的微量离心管中加入100μL每种稀释液。将这些试管保存为rAb标准品,以便在伽马计数器中测定。
- 将板在37°C下孵育1小时,轻轻摇动。
5. 清洗板并测定放射性
- 为每个孔(A1至A6,B1至B6 ...) 标记微量离心管通过 H1-H6)。如果需要,使用两种不同的彩色标记对样品进行颜色编码 - 一种用于涂有抗原的孔,另一种用于仅具有BSA的孔。
- 使用真空抽吸器从每个孔中抽吸rAb。
- 使用多通道移液器,向每个孔中加入300μL洗涤缓冲液。吸出洗涤缓冲液。重复洗涤共五次。
- 将孔分解成适当的微量离心管。
- 使用伽马计数器计算管中的放射性。首先计数含有抗原(H1,H2,H3至A1,A2,A3)的管子,然后仅计数具有BSA的管子(H4,H5,H6至A4,A5,A6)。为了最大限度地减少干扰,请在不同的时间单独计算每种稀释(H std到A std)的标准品。
6. 数据分析
注意:补充文件包含相应的电子表格和统计分析模板,用于分析和绘制数据。
- 在电子表格中,计算每个样本的总、特定和非特异性结合(请参阅作为补充文件附加的电子表格模板)。
- 计算“结合活性”,即样品的每分钟计数(CPM)(从伽马计数器获得)除以相应标准的CPM。将“% Bound”计算为 Bound Activity 乘以 100。
- 通过将“% Bound”与添加的rAb的浓度(mol / L)相乘来计算“总结合,mol / L”。通过将“总结合,摩尔/升”乘以以升(0.0001 L)为单位添加的rAb体积来计算“总结合,摩尔”。
- 通过从抗原稀释液中减去BSA稀释液的“总结合,摩尔”来计算“特异性结合,摩尔”,使得A1与A4配对,A2与A5配对,A3与A6配对,B1与B4配对等。
- 通过为每个孔从“总结合,mol”中减去“特异性结合,mol”来计算“非特异性结合,mol”。
- 在统计分析绘图软件中,绘制 x 轴上添加的 rAb (nmol/L) 与 y 轴上的结合 (mol) 的浓度。创建单独的组以一式三份总绑定、特定绑定和非特定绑定的形式绘制。通过在所使用的软件中选择以下参数来执行非线性拟合分析(材料表;请参阅作为补充文件附加的统计分析模板)。
- 选择“新建分析”。在 XY 分析下,选择非线性回归(曲线拟合)。确保在“分析哪些数据集?”下选择了所有数据,然后选择“确定”。
- 在“模型”选项卡上的“绑定 - 饱和度”下,选择“一个站点 - 特定绑定”。在置信度选项卡上,选择识别'不明确'拟合。将所有其他参数保留为默认值,然后选择“确定”。
注意:这将计算总结合、特异性和非特异性结合的 KD 和 Bmax。特异性结合的KD 是与抗原结合的rAb的kD ,单位为nmol/L。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
该方法基于饱和结合测定计算rAb的结合亲和力(KD),其中将不同浓度的rAb加入到固定量的固定化抗原中。结合曲线应遵循对数生长,其初始陡峭,然后随着抗原饱和而趋于平稳。为了确保确定的KD是准确的,rAb的浓度必须足够高才能达到饱和。对于该测定,放射性标记的抗体与DFO偶联并用89Zr进行放射性标记,如前所述19。图3显示了代表性的饱和结合图。放射性标记的amivantamab是一种用于表皮生长因子受体(EGFR)和细胞质间充质 - 上皮转化(cMET)蛋白的双特异性抗体,与EGFR(图3A)和cMET(图3B)蛋白19结合。还显示了与EGFR(图3C)和cMET(图3D)蛋白结合的单臂放射性标记Fabs的饱和结合图19。在所有子图中,非线性回归曲线都代表了稀释序列,曲线的异常值最少。特定绑定对应于总绑定的大部分。虽然非特异性结合总体上较低,但较高浓度的rAb显示出更大的非特异性结合,表明该测定中非特异性结合的可能阈值。rAb的结合亲和力在预期的纳摩尔范围内。单臂α-EGFR和α-cMET的KD值分别为8.4±1.7 nM和4.2±1.5 nM,对靶抗原的亲和力分别与双特异性rAb相似,对于EGFR和cMET,KD值为9.9±2.1 nM和16.9±5.9 nM。
图4显示了放射性标记的α-cMET与固定化cMET蛋白结合的次优实验,以证明需要优化的参数的结果。在图4A中,添加的rAb的浓度范围太低,并且未达到饱和度,如结合曲线未达到平台所示。这些条件导致添加的rAb浓度与结合的rAb浓度的线性图。由于数据与非线性回归模型不拟合,因此在统计分析中确定 KD 值为“模糊”。在图4B中,用于放射性标记的α-cMET的浓度过高。达到饱和度,如结合曲线的水平平台所示。然而,非特异性结合明显有助于总结合。这些条件导致KD值为14.9 nM,95%置信区间为4.8 - 44.2 nM,从而产生了大量的不确定性。因此,优化添加的rAb的浓度范围,如图3D所示,将提供更准确的KD值。饱和结合曲线基于反应动力学的Michaelis-Menten方程。当点随机分布在回归线17 周围时,曲线是一个很好的拟合。置信区间较窄表示 KD 值是准确的。

图 3:用于确定 KD 的饱和度结合图。 [89Zr]Zr-DFO-amivantamab 与 (A) EGFR 和 (B) cMET 蛋白、(C) [89Zr]Zr-DFO-α-EGFR 蛋白和 (D) [89Zr]Zr-DFO-α-cMET 与 cMET 蛋白的结合曲线,以计算结合亲和力。误差线表示每种浓度结合的 89Zr标记抗体的标准偏差。KD 和Bmax 的平均±SD来自每种条件的三个独立实验。这个数字在Cavaliere等人19的许可下被重复使用。 请点击此处查看此图的大图。
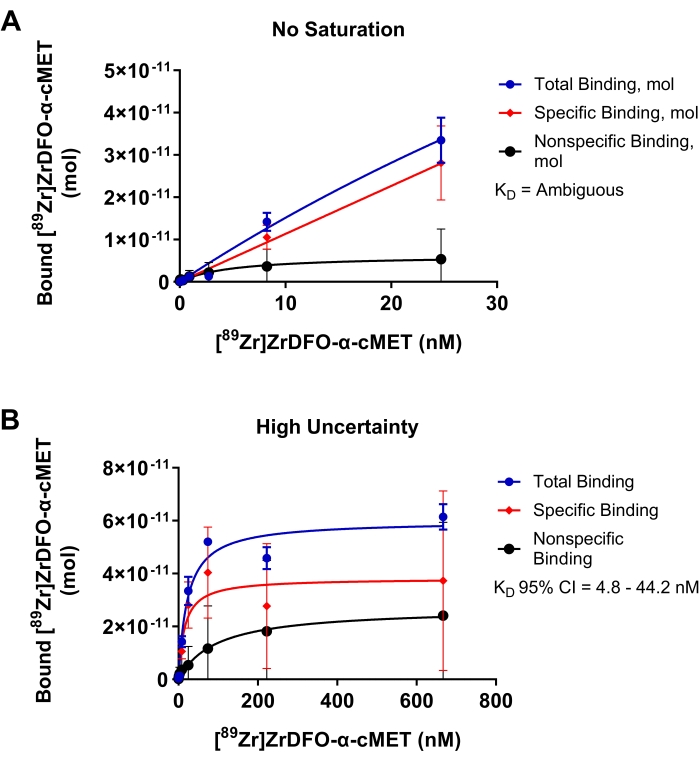
图 4:无法准确确定 KD 的饱和度结合图。 [89Zr]Zr-DFO-α-cMET与cMET蛋白的结合。误差线表示边界 [89Zr]Zr-DFO-α-cMET 的标准差。(A)[89Zr]Zr-DFO-α-cMET的浓度太低,未达到饱和度。KD 无法计算,因为曲线是线性的,并且与非线性回归模型不拟合。(B)KD (4.8-44.2 nM)的广义95%置信区间(CI)表明了特异性结合的高不确定性。由于高浓度的 rAb,也存在高非特异性结合。 请点击此处查看此图的大图。
补充文件。请点击此处下载此文件。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
作为rAb开发的一部分,重要的是要确保rAb特异性地结合到其具有高结合亲和力的靶标。确定结合亲和力可以告知rAb的免疫反应性是否受到使用固定抗原的放射性配体饱和度测定的放射性结合的影响。确定 rAb 与 BSA 的结合可用于量化非特异性结合,以更准确地测量与固定抗原的特异性结合。该方法测试不同浓度的rAb的结合,以产生饱和结合曲线,以计算KD 并确定结合亲和力。
为了进行这种测定,必须具有正在研究的rAb的抗原。抗原需要具有抗体与之结合的表位。在新型抗体具有未知结合表位的情况下,确定结合亲和力的非放射性标记方法可能更合适。在开始实验之前,建议进行文献检索。以前用于基于ELISA的测定中的目标抗原可能对该测定有效。
根据放射性核素的半衰期和伽马计数器的灵敏度,标准品可能需要一段时间才能衰变到伽马计数器定量限值内的放射性水平。如果预计伽马计数器的放射性水平太高,请稀释标准样品,然后在数据分析中乘以稀释因子。此步骤应在实验当天完成,以避免抗体聚集或降解的可能性,这可能导致标准溶液不均匀和读数不准确。
生成适当形状的饱和曲线基于所选的稀释系列。这个过程需要反复试验。无法推广rAbs的浓度是该方案的局限性,因为所有rAb都对其抗原具有不同的结合亲和力。应针对每个 rAb 优化此协议。优化后,实验方案应可针对特定 rAb 重现。浓度范围和稀释因子可能需要根据曲线的形状进行调整。鉴于抗体结合的预期纳摩尔范围,从该范围的最广泛表示开始,将允许人们放大感兴趣的更窄的浓度范围,以供将来的试验使用。而不是八次连续稀释,十六次将提供更多的数据点来理解结合的范围。如果已知未偶联抗体的KD ,建议在首次设计研究时使用该值作为范围的中间浓度。根据材料的可用性,具有不同浓度范围和稀释因子的多个正在进行的试验可以相对更快地优化方案。可以调整孵育时间以确保达到饱和度。此外,如果即使在饱和时结合也很低,则可能没有足够的信号范围来准确计算KD。可能需要优化固定抗原的浓度。可以使用不同浓度的固定抗原和rAb的储备浓度进行初步研究,以确定最大结合信号。
与其他非放射性标记方法(如流式细胞术或表面等离子体共振(SPR))相比,放射性配体饱和度测定是一种成熟的方法,具有许多益处,可用于确定rAb的结合亲和力。采用非放射性标记抗体检测的方法确定由偶联和非偶联抗体组成的混合样品的结合亲和力。在放射性配体饱和度测定中,唯一记录的信号是放射性标记的抗体偶联物,它为放射性标记的物种提供了更准确的KD ,这将影响生物医学应用。这种考虑使得放射性配体饱和度测定的结果和非放射性标记技术的结果实际上无法比拟,因为它们测量不同的样品 - rAb与rAb加亲本抗体。一项研究比较了非放射性标记抗体螯合物偶联物与亲本双特异性抗体在固定化蛋白上使用 SPR 的结合亲和力。抗体螯合物偶联物和亲本抗体的KD 值之间存在五倍的差异。在多个细胞系上,SPR和饱和度测定之间发现的KD 值的差异范围为10至1,000倍23。非放射性标记抗体螯合剂是偶联和非偶联抗体的混合物,而饱和度测定测定的KD 值仅来自放射性标记的偶联抗体。所用细胞系之间的抗原表达也存在差异。因此,非放射性标记技术不能用于验证放射性配体饱和度测定。然而,一旦确定了rAb的KD ,就可以进行竞争性结合测定以确定抗体17,21的亲本和偶联变体之间的结合差异。
放射配体饱和度测定可以扩展以确定rAb与细胞的饱和结合,而不是固定的抗原。使用相同的概念,可以将不同浓度的rAb添加到固定数量的细胞中。然后,方案中概述的数据分析可用于确定rAb与细胞的结合亲和力,这也将确定Bmax 以计算目标细胞系上存在的抗原分子的数量。该方法还可以推广到其他放射性标记的蛋白质和肽支架,以确定它们与其靶标的特异性结合。总之,该协议描述了确定rAb与固定化蛋白质抗原的结合亲和力的过程。该过程使用基本的实验室技术对rAb进行连续稀释以添加到固定的抗原中。最具挑战性的方面是确定rAb的浓度以产生适当形状的饱和结合曲线。该过程需要在单个rAb的测定开发中进行反复试验,但一旦建立,就可以重现。计算出的KD 可用作免疫反应性的指标,作为推进成像或治疗应用或改进抗体 - 螯合物偶联反应的标准。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有利益冲突。
Acknowledgments
作者感谢3D Imaging生产[89Zr]Zr-草酸盐,以及Janssen Pharmaceuticals的Sheri Moores博士提供抗体。
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P. Radioligand binding assays and their analysis. in Receptor Binding Techniques. Davenport, A. P. , Humana Press. 31-77 (2012).
- Davenport, A. P., Russell, F. D. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. Mather, S. J. , Springer. Netherlands. 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).



