3.9:
실험을 통한 화학식 측정
3.9:
실험을 통한 화학식 측정
화합물의 원소 메이크업은 화학적 정체성을 정의하며 화학 포뮬러는 이 원소 메이크업을 나타내는 가장 간결한 방법입니다. 화합물의 공식이 알려지지 않은 경우 구성 요소의 질량을 측정하는 것은 종종 수식을 실험적으로 결정하는 첫 번째 단계입니다.
경험적 수식 의 결정
화합물의 화학 공식을 결정하는 가장 일반적인 접근 방식은 먼저 성분 요소의 질량을 측정하는 것입니다. 그러나, 화학 수식상대 적인 숫자를 나타냅니다 및 물질에 원자의 질량. 따라서 질량을 포함하는 모든 실험적으로 파생된 데이터는 화합물내의 상응하는 원자 수를 얻기 위해 사용해야 한다. 이것은 어금니 덩어리를 사용하여 각 요소의 질량을 두더지 의 수로 변환합니다. 이러한 어금반 양은 물질의 경험적 공식을 도출하는 데 사용할 수 있는 전체 숫자 비율을 계산하는 데 사용됩니다.
탄소 1.71그램과 0.287그램의 수소를 함유하기로 결정한 화합물의 샘플을 고려하십시오. 원자의 해당 수는 탄소의 0.142 두더지와 수소의 0.284 두더지입니다. 따라서, 이 화합물은 포뮬러 C0.142H0.284로나타낼 수 있다. 규칙당 수식에는 각 하위 스크립트를 가장 작은 하위 스크립트(0.142)로 나누어 얻을 수 있는 전체 숫자 하위 스크립트가 포함되어 있습니다. 이 화합물에 대한 경험적 포뮬러는 따라서 CH2이다. “1”의 하위 스크립트는 작성되지 않고 다른 번호가 없는 경우 가정됩니다. 이것은 화합물의 분자 포뮬러일 수도 또는 그렇지 않을 수도 있습니다. 그러나 이러한 결정을 내리기 위해서는 추가 정보가 필요합니다.
두 번째 예로, 화합물의 샘플은 5.31 그램의 염소와 8.40 그램의 산소를 함유하는 것으로 결정됩니다. 동일한 접근 방식은 ClO3.5의잠정적인 경험적 공식을 산출합니다. 이 경우 가장 작은 하위 스크립트로 나누는 것은 여전히 경험적 수식에 소수체를 남깁니다. 이를 전체 숫자로 변환하려면 각 하위 스크립트를 2개로 곱하여 동일한 원자 비율을 유지하고 Cl2O7을 최종 경험적 수식으로 산출합니다.
백분율 구성에서 경험적 수식 을 도출
화합물의 백분율 조성이 가능한 경우 화합물에 존재하는 원소의 질량을 계산하는 데 사용됩니다. 백분율의 배율이 100이기 때문에 100g의 샘플에 존재하는 요소의 질량을 계산하는 것이 편리합니다. 얻어진 질량은 경험적 공식을 도출하는 데 사용됩니다.
예를 들어, 기체 화합물이 27.29% C 및 72.71% O를 함유한다고 가정합니다. 따라서 질량 백분율은 분수로 표시됩니다.


탄소 질량인 27.29g은 탄소 2.272두개의 두더지와 일치하며, 산소 의 질량인 72.71g은 4.544개의 산소 두더지와 일치한다. 따라서 대표적인 공식은 C2.272O4.544입니다. 각 하위 스크립트를 2.272로 나누면 경험적 공식인 CO2.
분자 포뮬러의 파생
공유 화합물의 단일 분자를 구성하는 원자의 절대 수를 결정하는 것은 그것의 경험적인 공식 및 그것의 분자 질량 또는 어금니 질량 둘 다의 지식이 필요합니다. 이러한 수량은 다양한 측정 기술에 의해 실험적으로 결정될 수 있다. 분자 질량은, 예를 들어, 종종 화합물의 질량 스펙트럼으로부터 파생된다.
분자 포뮬러는 화합물의 어금니 질량 또는 분자 질량을 경험적 포뮬러 질량과 비교하여 파생됩니다. 이름에서 알 수 있듯이, 경험적 공식 질량은 경험적 공식으로 표현된 모든 원자의 평균 원자 질량의 합입니다. 물질의 공지된 어금니 질량이 경험적 수식 질량으로 나뉘면, 분자당 경험적수식 단위의 수를 산출한다(n).
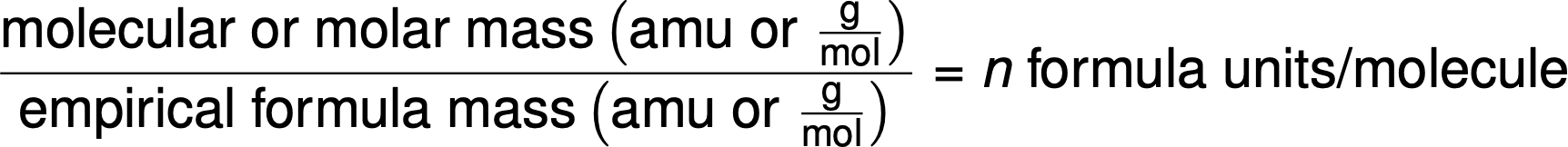
분자 포뮬러는 일반 경험적 포뮬러 AxBy에의해 도시된 바와 같이, 경험적 포뮬러에서 각 하위 스크립트를 n에곱하여 얻어진다.
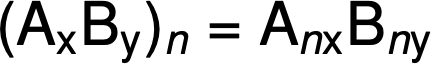
예를 들어, 공유 화합물의 경험적 포뮬러는 CH2O로 결정되고, 그 경험적 포뮬러 질량은 약 30개의 무루이다. 화합물의 분자 질량이 180 amu로 결정되면, 이것은 이 화합물의 분자가 경험적 포뮬러에서 표현되는 원자의 6배를 포함하고 있음을 나타낸다.
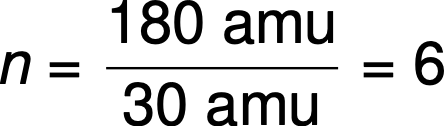
이 화합물의 분자는 경험적 포뮬러에 있는 그들 보다 6 배 더 큰 하위 스크립트를 가진 분자 포뮬러로 표현됩니다: (CH2O)6 = C6H12O6.
