3.9:
Determinação Experimental de Fórmulas Químicas
3.9:
Determinação Experimental de Fórmulas Químicas
A composição elementar de um composto define a sua identidade química, e as fórmulas químicas são a maneira mais concisa de representar esta composição elementar. Quando a fórmula de um composto é desconhecida, medir a massa dos seus elementos constitutivos é muitas vezes o primeiro passo para determinar experimentalmente a fórmula.
Determinação de Fórmulas Empíricas
A abordagem mais comum para a determinação da fórmula química de um composto é medir primeiro as massas dos seus elementos constituintes. No entanto, as fórmulas químicas representam os números relativos e não as massas de átomos na substância. Portanto, qualquer dado derivado experimentalmente envolvendo massa deve ser usado para obter os números correspondentes de átomos no composto. Isto é feito usando massas molares para converter a massa de cada elemento para o seu número de moles. Essas quantidades molares são usadas para calcular as razões de número inteiro que podem ser usadas para derivar a fórmula empírica da substância.
Considere uma amostra de um composto que se determinou conter 1,71 gramas de carbono e 0,287 gramas de hidrogénio. Os números correspondentes de átomos são 0,142 moles de carbono e 0,284 moles de hidrogénio. Assim, este composto pode ser representado pela fórmula C0,142H0,284. Por convenção, as fórmulas contêm os subscritos do número inteiro, que podem ser alcançados dividindo cada subscrito pelo menor subscrito (0,142). A fórmula empírica para este composto é, portanto, CH2. Os subscritos de “1” não são escritos, mas sim assumidos se nenhum outro número estiver presente. Esta pode ou não ser a fórmula molecular do composto; no entanto, são necessárias informações adicionais para fazer essa determinação.
Como segundo exemplo, determina-se que uma amostra de um composto contém 5,31 gramas de cloro e 8,40 gramas de oxigénio. A mesma abordagem produz uma fórmula empírica provisória de ClO3,5. Neste caso, a divisão pelo menor subscrito ainda deixa um decimal na fórmula empírica. Para converter isto em um número inteiro, multiplica-se cada um dos subscritos por dois, mantendo a mesma relação de átomos e produzindo Cl2O7 como a fórmula empírica final.
Derivação de Fórmulas Empíricas a Partir de Composição Percentual
Nos casos em que a composição percentual de um composto está disponível, ela é usada para calcular as massas dos elementos presentes no composto. Uma vez que a escala das percentagens é de 100, é conveniente calcular a massa dos elementos presentes em uma amostra de 100 gramas. As massas obtidas são usadas para derivar a fórmula empírica.
Por exemplo, suponha que um composto gasoso contém 27,29% C e 72,71% O. As percentagens de massa são, portanto, expressas em frações:


A massa de carbono, 27,29 g, corresponde a 2,272 moles de carbono, e a massa de oxigénio, 72,71 g, corresponde a 4,544 moles de oxigénio. A fórmula representativa é, portanto, C2,272O4,544. Dividindo cada subscrito por 2,272 fornece a fórmula empírica: CO2.
Derivação de Fórmulas Moleculares
Determinar o número absoluto de átomos que compõem uma única molécula de um composto covalente requer o conhecimento da sua fórmula empírica e da sua massa molecular ou massa molar. Estas quantidades podem ser determinadas experimentalmente por várias técnicas de medição. A massa molecular, por exemplo, é muitas vezes derivada do espectro de massa do composto.
As fórmulas moleculares são derivadas comparando a massa molar ou massa molecular do composto com a massa da sua fórmula empírica. Como o nome sugere, massa de fórmula empírica é a soma das massas atómicas médias de todos os átomos representados em uma fórmula empírica. Se a massa molar conhecida de uma substância for dividida pela massa de fórmula empírica, obtém-se o número de unidades de fórmula empírica por molécula (n).
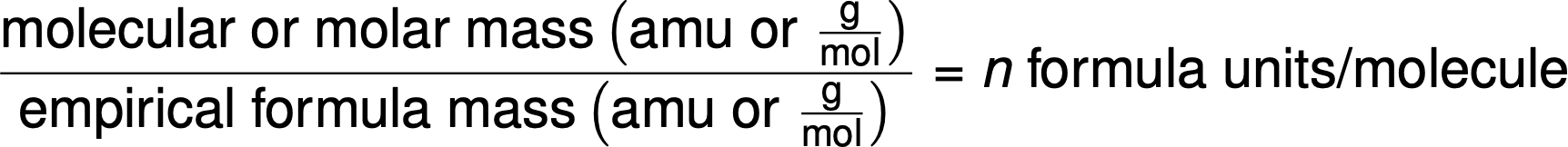
A fórmula molecular é então obtida multiplicando cada subscrito da fórmula empírica por n, como mostra a fórmula empírica genérica AxBy:
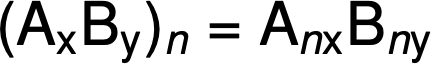
Por exemplo, determina-se que a fórmula empírica de um composto covalente é CH2H, e a sua massa de fórmula empírica é de aproximadamente 30 amu. Se a massa molecular do composto for determinada como 180 amu, isso indica que as moléculas desse composto contêm seis vezes o número de átomos representados na fórmula empírica.
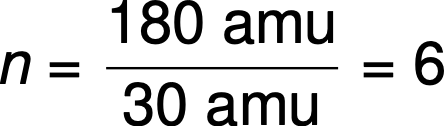
As moléculas desse composto são então representadas por uma fórmula molecular com subscritos seis vezes maiores que as da fórmula empírica: (CH2O)6 = C6H12O6.
Este texto é adaptado de Openstax, Chemistry 2e, Section 3.2: Determining Empirical and Molecular Formulas.
