5.3:
理想气体定律的应用:摩尔质量、密度和体积
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Applications of the Ideal Gas Law: Molar Mass, Density, and Volume
所有理想气体都在作用上符合 由理想气体定律所决定的,压力、体积、莫耳数和温度之间的特定关系,在这个方程式中,R是理想气体常数。只要已知其它三个,重新排列这个方程式 可以算出任何一个变量。例如,在标准温度和压力的条件下,一莫耳里想气体的 体积是多少?缩写为 STP 这些条件 是 0 摄氏度或 273 K和一大气压。重新排列方程式并代入值:n,1 莫耳,温度,273K,压力,1大气压 和理想气体常数,0.08206 升大气压 莫耳K,一莫耳的理想气体占体积 22.4 升。这是 STP 的莫耳体积,也是 许多常见气体不错的估计值。在较高的温度和较低的压力下,气体膨胀,而它的莫耳体积 大于标准条件下的莫耳体积。在较低的温度和较高的压力下,莫耳体积较小。气体的另一个常用的量是密度。回想一下莫耳数,n,等于气体的质量除以它的莫耳质量。代换这个关系到理想气体方程式,然后重新排列,会产生一个式子 质量除以体积或密度。根据这个方程式,气体的密度 与它的莫耳质量成正比。在外面释放时,这就是氦气气球会漂走的原因。氦的莫耳质量,和密度,比主要是氮气和氧气的空气少很多。另外,注意 密度和温度是成反比。在驾驶热气球的时候观察得到。开燃烧器加热气球里面的空气分子,而他们移动更快。气球里面的压力增加,但是气球的设计使得有些空气会逸散。这会让气球里的空气密度低于 周遭的空气。因为这个密度的差异,气球会上升。相反的,关掉燃烧器和打开通风口,会让暖空气逸散。当气球收缩,外部空气 进入,相对于周遭,气球的密度增加了,然后由于篮子的重量,气球下降。方程式重新排列后,也 让我们能够计算未知气体的莫耳质量。假设一个未知气体,它的质量是 12.5 克,体积为 6.08,压力是 1.2 大气压,在摄氏 40 度。气体的密度可以从给定的质量和体积中得知。然后,以摄氏度为单位的温度 转换为以K为单位,并与压力值和气体常数 一起代入方程式。求M,得出44克每莫耳的莫耳质量。所以二氧化碳就是这个未知气体。
5.3:
理想气体定律的应用:摩尔质量、密度和体积
一摩尔物质所占的体积是其摩尔体积。理想气体定律 PV = nRT ,建议给定数量的气体的体积和给定体积的气体的摩尔数随压力和温度。在标准温度和压力或STP(273.15 K和1个大气压)下,一摩尔理想气体(无论其身份如何)的体积约为22.4L。这就是标准摩尔体积。
例如,在STP处,一摩尔的氢,氧,氩或二氧化碳占22.4升。这意味着在STP处任何0.5摩尔的气体占11.2 L的体积,同样,在STP处任何2摩尔的气体占44.8 L的体积。
理想气体定律是通用的,与气体的压力,体积,摩尔数和温度有关,而与气体的化学特性无关:
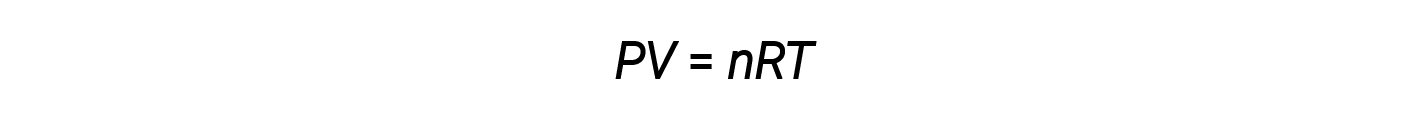
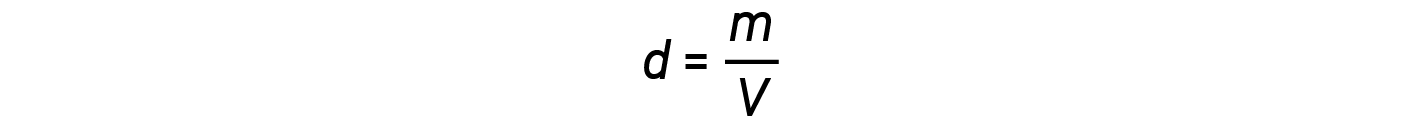
质量与摩尔 m / n 的比值,即摩尔质量的定义, M :
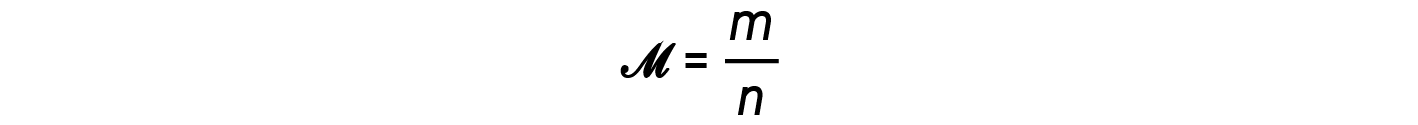
然后可以将密度方程写为
这个方程告诉我们,气体密度与压力和摩尔质量成正比,与温度成反比。例如,CO 2 (摩尔质量= 44 g / mol)比N 2 (摩尔质量= 28 g / mol)或O 2 (摩尔质量= 32 g / mol),因此比空气更致密。因此,从CO 2 灭火器释放的CO 2 掩盖了火势,阻止了O 2 到达可燃物。热气球升起的现象取决于以下关系:等摩尔质量的气体(例如空气)在较高温度下具有较低的密度,因此热气球可以漂浮。
