5.3: Aplicações da Lei de Gás Ideal: Massa Molar, Densidade, e Volume
O volume ocupado por um mole de uma substância é o seu volume molar. A lei de gás ideal, PV = nRT, sugere que o volume de uma determinada quantidade de gás e o número de moles em um determinado volume de gás variam com alterações na pressão e na temperatura. À temperatura e pressão padrão, ou STP (273,15 K e 1 atm), um mole de um gás ideal (independentemente da sua identidade) tem um volume de cerca de 22,4 L— isto é referido como o volume molar padrão.
Por exemplo, um mole cada de hidrogénio, oxigénio, árgon, ou dióxido de carbono ocupa 22,4 litros em STP. Isto implica que 0,5 moles de qualquer gás em STP ocupa um volume de 11,2 L, e da mesma forma, 2 moles de qualquer gás em STP ocupa um volume de 44,8 L.
A lei de gás ideal é universal, relacionando a pressão, o volume, o número de moles, e a temperatura de um gás, independentemente da identidade química do gás:
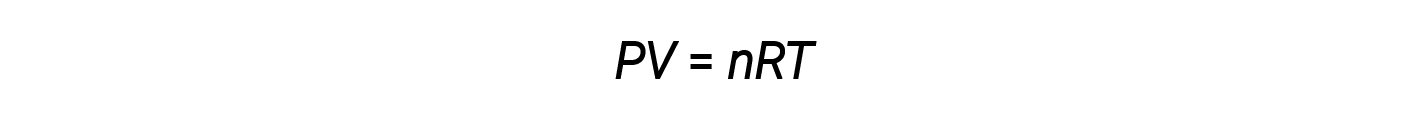
A densidade d de um gás, por outro lado, é determinada pela sua identidade. Densidade é a relação de massa sobre o volume. Reorganizando a equação de gás ideal para isolar V e substituindo-a pela equação de densidade obtemos:
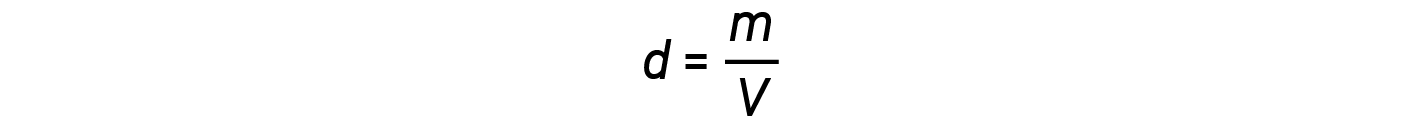
A razão m/n, ou seja, massa sobre moles, é a definição de massa molar, M:
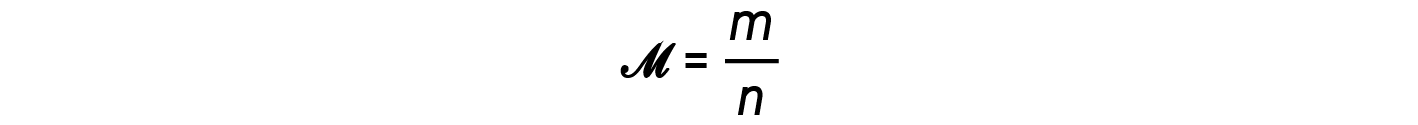
A equação de densidade pode então ser escrita como
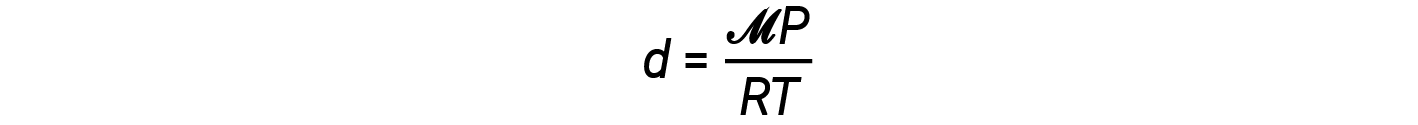
Esta equação diz-nos que a densidade do gás é diretamente proporcional à pressão e massa molar, e inversamente proporcional à temperatura. Por exemplo, o CO2 (massa molar de 44 g/mol) é mais pesado do que o N2 (massa molar de 28 g/mol) ou o O2 (massa molar de 32 g/mol) e é, portanto, mais denso do que o ar. Por essa razão, o CO2 libertado de um extintor de incêndio de CO2 abafa um incêndio, impedindo que o O2 chegue ao material combustível. O fenómeno da elevação de balões de ar quente depende da relação em que gases de massas molares iguais (como o ar) têm densidades mais baixas em temperaturas mais altas, e portanto balões de ar quente podem flutuar.
Este texto é adaptado de Openstax, Chemistry 2e, Section 9.3: Stoichiometry of Gaseous Substances, Mixtures, and Reactions.


