5.3: 理想气体定律的应用:摩尔质量、密度和体积
一摩尔物质所占的体积是其摩尔体积。理想气体定律 PV = nRT ,建议给定数量的气体的体积和给定体积的气体的摩尔数随压力和温度。在标准温度和压力或STP(273.15 K和1个大气压)下,一摩尔理想气体(无论其身份如何)的体积约为22.4L。这就是标准摩尔体积。
例如,在STP处,一摩尔的氢,氧,氩或二氧化碳占22.4升。这意味着在STP处任何0.5摩尔的气体占11.2 L的体积,同样,在STP处任何2摩尔的气体占44.8 L的体积。
理想气体定律是通用的,与气体的压力,体积,摩尔数和温度有关,而与气体的化学特性无关:
质量与摩尔 m / n 的比值,即摩尔质量的定义, M :
然后可以将密度方程写为
这个方程告诉我们,气体密度与压力和摩尔质量成正比,与温度成反比。例如,CO 2 (摩尔质量= 44 g / mol)比N 2 (摩尔质量= 28 g / mol)或O 2 (摩尔质量= 32 g / mol),因此比空气更致密。因此,从CO 2 灭火器释放的CO 2 掩盖了火势,阻止了O 2 到达可燃物。热气球升起的现象取决于以下关系:等摩尔质量的气体(例如空气)在较高温度下具有较低的密度,因此热气球可以漂浮。
本文改编自 Openstax,化学2e,第9.3节:气态物质,混合物和反应的化学计量。
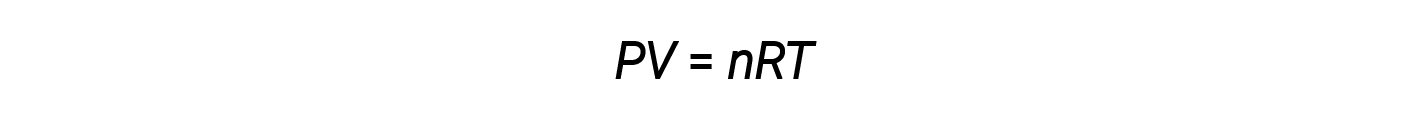
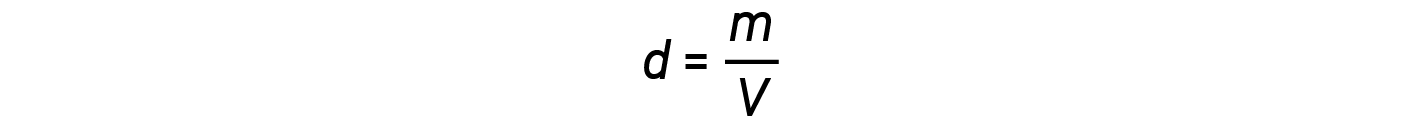
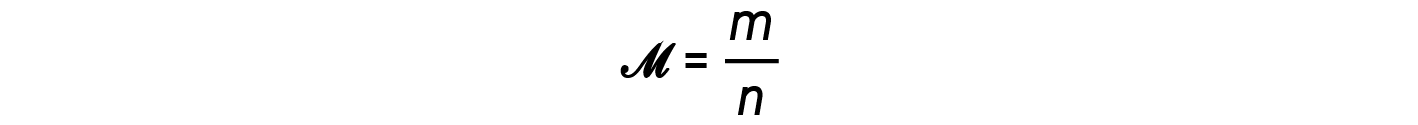
Tags
Ideal Gas Law
Pressure
Volume
Moles
Temperature
Gas Constant
STP
Molar Volume
Density
Molar Mass


