5.4:
Смесь газов - закон парциальных давлений Дальтона
5.4:
Смесь газов - закон парциальных давлений Дальтона
Если отдельные газы не вступают в химическую реакцию друг с другом, отдельные газы в смеси газов не влияют на давление друг друга. Каждый газ в смеси оказывает такое же давление, какое он оказывал бы, если бы он находился в контейнере отдельно. Давление, оказываемое каждым отдельным газом в смеси, называется его парциальным давлением.
Это означает, что в смеси, содержащей три разных газа A, B и C, если P A – парциальное давление газа A; P B – парциальное давление газа B; P C – парциальное давление газа C; тогда полное давление определяется уравнением 1: & nbsp;
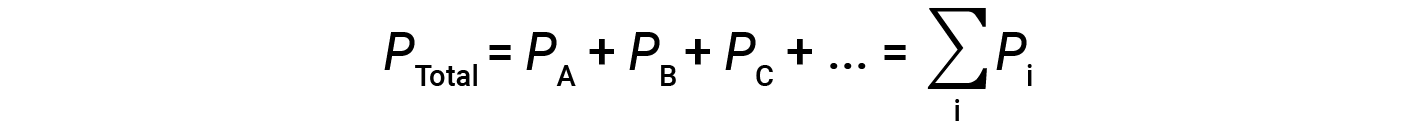
Это закон парциальных давлений Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений составляющих газов.
Пусть n A , n B и n C – количество молей каждого из газов в смеси. Если каждый газ подчиняется уравнению идеального газа, парциальное давление можно записать как:
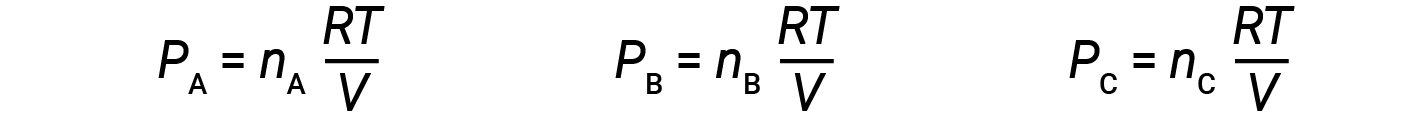
Поскольку все газы имеют одинаковую температуру и занимают одинаковый объем, подстановка в уравнение 1 дает:
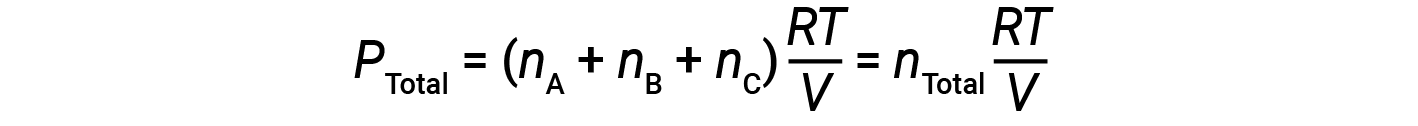
Уравнение показывает, что при постоянной температуре и постоянном объеме полное давление пробы газа определяется общим количеством присутствующих молей газа.
Для смесей газов удобно вводить величину, называемую мольной долей, & chi ;, которая определяется как количество молей определенного вещества в смеси, деленное на общее количество молей всех присутствующих веществ. Математически мольная доля вещества A в смеси с B и C выражается как
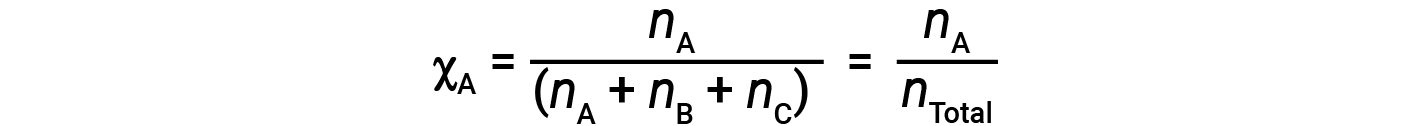
Точно так же мольные доли B и C:
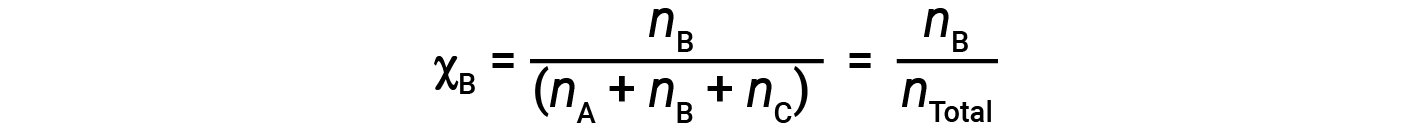
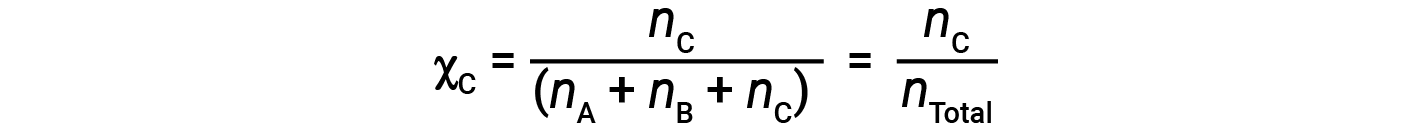
Объединение уравнения для мольной доли A и уравнения для парциального давления дает:
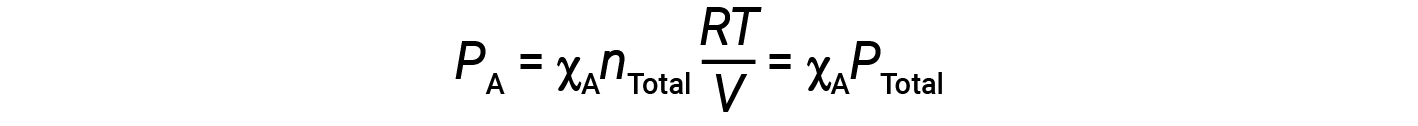
Парциальное давление газа A связано с общим давлением газовой смеси через его мольную долю.
Другими словами, давление газа в смеси газов является произведением его мольной доли и общего давления смеси.
Этот текст адаптирован из Openstax, Химия 2е изд., Раздел 9.3: Стехиометрия газообразных веществ, смесей и реакций.
