5.4:
Miscela di gas - Legge di Dalton delle pressioni parziali
5.4:
Miscela di gas - Legge di Dalton delle pressioni parziali
A meno che i singoli gas non reagiscano chimicamente tra loro, i singoli gas in una miscela di gas non influenzano la pressione l’uno dell’altro. Ogni gas di una miscela esercita la stessa pressione che eserciterebbe se fosse presente da solo nel contenitore. La pressione esercitata da ogni singolo gas in una miscela è chiamata pressione parziale.
Ciò significa che in una miscela contenente tre diversi gas A, B e C, se PA è la pressione parziale del gas A; PB è la pressione parziale del gas B; PC è la pressione parziale del gas C; allora la pressione totale è data dall’equazione 1:
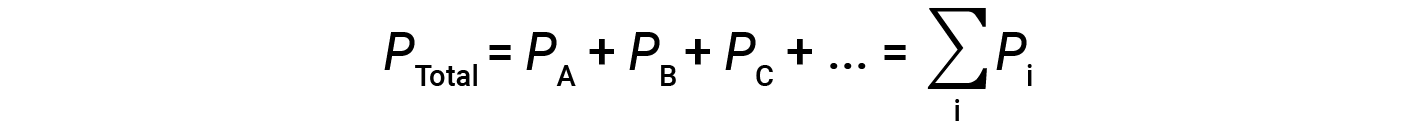
Questa è la legge di Dalton delle pressioni parziali: La pressione totale di una miscela di gas ideali è uguale alla somma delle pressioni parziali dei gas componenti.
Sia nA, nBe nC il numero di talpe di ciascuno dei gas nella miscela. Se ogni gas obbedisce all’equazione del gas ideale, la pressione parziale può essere scritta come:
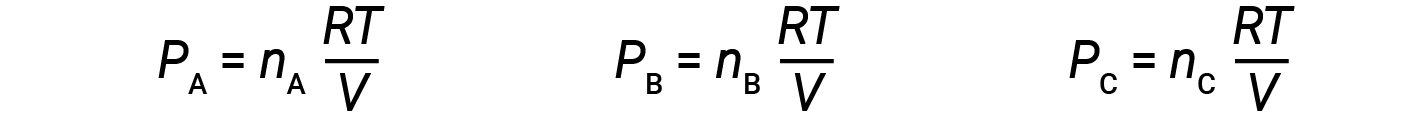
Poiché tutti i gas sono alla stessa temperatura e occupano lo stesso volume, la sostituzione nell’equazione 1 dà:
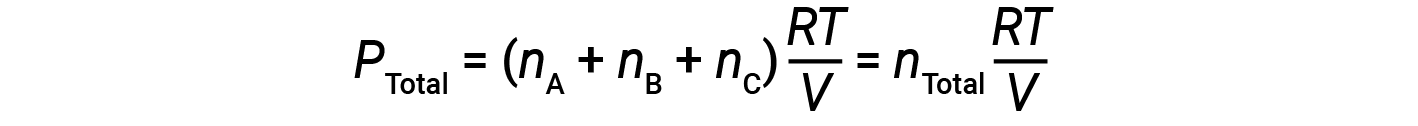
L’equazione indica che a temperatura costante e volume costante, la pressione totale di un campione di gas è determinata dal numero totale di talpe di gas presenti.
Per le miscele di gas, è conveniente introdurre una quantità chiamata frazione talpa, χ, che è definita come il numero di talpe di una particolare sostanza in una miscela divisa per il numero totale di talpe di tutte le sostanze presenti. Matematicamente, la frazione talpa di una sostanza A in una miscela con B e C è espressa come
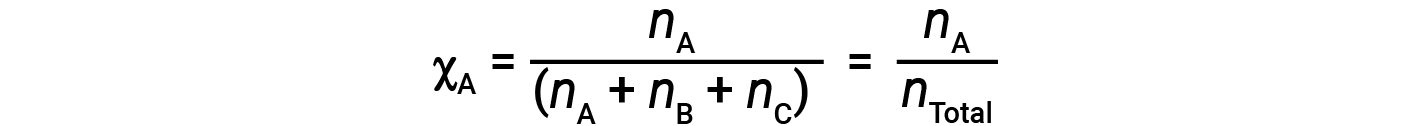
Allo stesso modo, la frazione talpa di B e C sono;
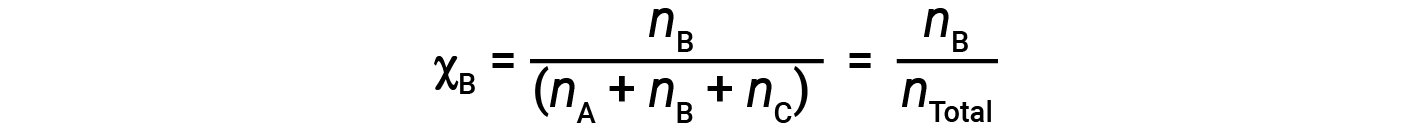
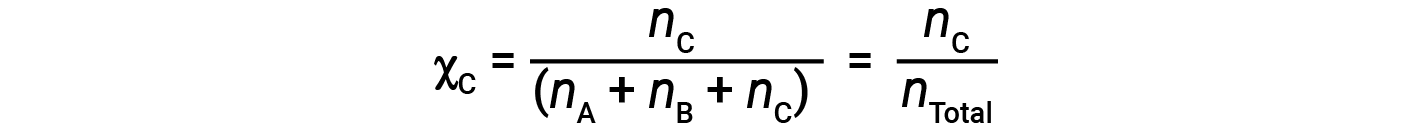
Combinando l’equazione per la frazione talpa di A e l’equazione per la pressione parziale si ottiene:
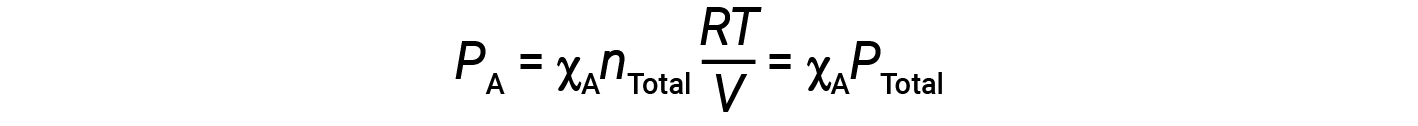
La pressione parziale del gas A è correlata alla pressione totale della miscela di gas attraverso la sua frazione di talpa.
In altre parole, la pressione di un gas in una miscela di gas è il prodotto della sua frazione di talpa e della pressione totale della miscela.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 9.3: Stechiometria di sostanze gassose, miscele e reazioni.
