6.3:
내부에너지
6.3:
내부에너지
물질에 존재하는 모든 가능한 종류의 에너지의 총은 내부 에너지(U)라고하며때로는 E로상징됩니다. 초기 내부 에너지를 가진 시스템, U초기,에너지의 변화를 겪고 가정 (작업 또는 열의 전송), 시스템의 최종 내부 에너지는 U최종입니다. 내부 에너지의 변화는 U 최종 및 U초기의차이와 같습니다.
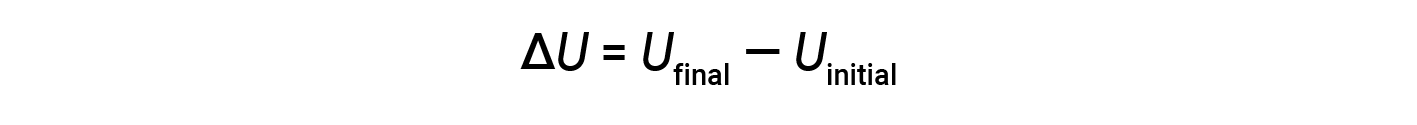
U최종 및 U초기값은 시스템에 대해 결정할 수 없지만, 열역학의 첫 번째 법칙은 ΔU의값만 요구하며, 이는 U최종 및 U초기값을알지 못하더라도 결정할 수 있습니다. ΔU의 양수 값은 U최종 > U초기때 발생하며, 시스템이 주변에서 에너지를 얻었다는 것을 나타냅니다. ΔU의 음수 값은 U최종 & U초기때 얻어지며 시스템이 주변 환경에 에너지를 잃었음을 나타냅니다.
열(열 에너지)과 작업(기계 에너지)은 시스템이 주변과 에너지를 교환할 수 있는 두 가지 방법입니다. 에너지는 주변환경으로부터열(q)을흡수하거나 주변환경이 작동할 때시스템(w)을시스템으로 전달한다.
예를 들어, 에너지는 온수(와이어가 물에서 열을 흡수함) 또는 전선이 앞뒤로 빠르게 구부러질 때 실온 금속 와이어로 전달됩니다(전선은 그 위에 행해지는 작업 때문에 따뜻해집니다). 두 공정 모두 와이어의 내부 에너지를 증가시며 와이어의 온도 증가에 반영됩니다. 반대로 시스템에서 열이 손실되거나 시스템이 주변 환경에서 작동할 때 에너지가 시스템에서 전송됩니다. 예를 들어, 로켓 연료의 연소는 엄청난 양의 열을 방출하고 또한 멀리 힘을 적용하여 주변 공사를 수행 (우주 왕복선이 지상에서 들어 올릴 원인). 두 프로세스 모두 시스템의 내부 에너지를 줄입니다.
내부 에너지, 열 및 작업 간의 관계는 방정식으로 나타낼 수 있습니다.
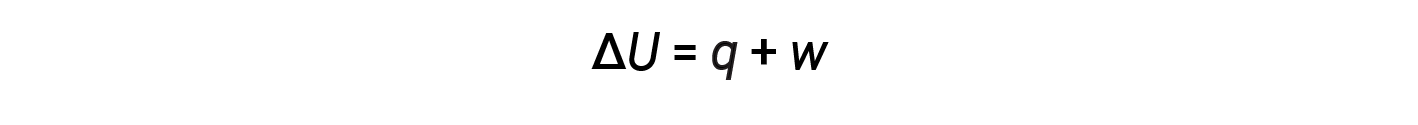
이것은 열역학의 첫 번째 법칙의 한 버전이며, 시스템의 내부 에너지가 시스템 또는 시스템의 내부 흐름 또는 작업 에서 또는 시스템에 의해 수행된다는 것을 보여줍니다. 열과 작업에 대한 징후는 시스템이 에너지를 얻거나 잃는지 여부에 따라 달라집니다. 양수 q는 주변시스템에서 시스템으로 의 열흐름이며, 음수 q는 시스템에서 열흐름입니다. 이 작업이 시스템에서 수행되고 시스템에 의해 수행되는 경우 부정적인 작업이 양수입니다.
Q와 w가 모두 양수(>0) 경우 ΔU는 항상 양수(>0)이며 시스템의 내부 에너지가 증가합니다. q와 w가 모두 음수(&0)인 경우 ΔU는 항상 음수(&0)이며 시스템의 내부 에너지가 감소합니다. q와 w에 다른 기호 규칙이 있는 경우 ΔU의 기호는 q 및 w의상대 적 크기에 따라 달라집니다.
에너지, 열 및 작업의 SI 단위는 줄 (J)입니다.
