9.8:
결합 극성, 쌍극자 모멘트, 퍼센트 이온성
9.8:
결합 극성, 쌍극자 모멘트, 퍼센트 이온성
본드 폴라리티
두 접착 원자의 전기특이성(ΔEN)의 차이의 절대값은 결합에서 예상되는 극성의 대략적인 척도를 제공하고, 따라서, 결합 유형. 차이가 매우 작거나 0이면 채권은 공유적이고 극적이지 않습니다. 큰 경우, 유대는 극성 공유 또는 이온입니다. 채권 H-H, H-Cl 및 Na-Cl의 원자 간의 전기성 차이의 절대값은 각각 0(극성), 0.9(극성 공유), 2.1(이온성)이다.
원자 간에 전자를 공유하는 정도는 완전히 동일 (순수한 공유 결합)에서 전혀 (이온 결합)에 이르기까지 다양합니다.
- 예를 들어, HF의 H 및 F 원자는 1.9의 전기적 차이를 가지며,NH3의 N 및 H 원자는 0.9의 차이를 가지지만, 이들 화합물 모두 극성 공유로 간주되는 결합을 형성한다.
- 마찬가지로 NaCl의 Na 및 Cl 원자는 2.1의 전기성 차이를 가지며 MnI2의 Mn 및 I 원자는 1.0의 차이를 가지지만 이온 화합물을 모두 형성합니다.
채권의 공유 또는 이온 특성에 대한 가장 좋은 가이드는 관련된 원자의 유형과 주기적인 표에서상대적 위치를 고려하는 것입니다.
- 두 비금속 사이의 결합은 일반적으로 공유됩니다.
- 금속과 비금속 사이의 결합은 종종 이온입니다.
일부 화합물은 공유 및 이온 결합을 모두 포함. OH–NO3–및 NH4+와 같은 다원자 이온의 원자는 극지 공유 결합에 의해 함께 개최됩니다. 그러나, 이러한 다원성 이온은 반대 전하의 이온과 결합하여 이온 화합물을 형성한다. 예를 들어, 질산칼륨, KNO3은K+ 양이온및 다원자 NO3– 음이온을 함유하고 있습니다. 따라서, 질산칼륨에 결합하는 것은 이온 K+와 NO3사이의정전기 매력에서 유래이온 – 뿐만 아니라 NO3에서질소와 산소 원자 사이의 공유– –.
분자 극성과 일극적 모멘트
앞서 설명한 바와 같이, 극지 공유 결합은 두 원자를 다른 전기적 전기적 전하와 연결하여, 전자가 더 전기음극쪽으로 당겨짐에 따라 부분적인 양전하(δ+) 및 다른 원자를 부분음전전(δ-)으로 남깁니다. 이 전하의 분리는 본드 이폴 순간을 야기합니다. 본드 이폴 순간의 크기는 그리스 문자 mu (μ)로 표현되며 Q가 부분 전하의 크기 (전기적 차이에 의해 결정됨)와 r이 전하 사이의 거리인 여기에 표시된 공식에 의해 제공됩니다.
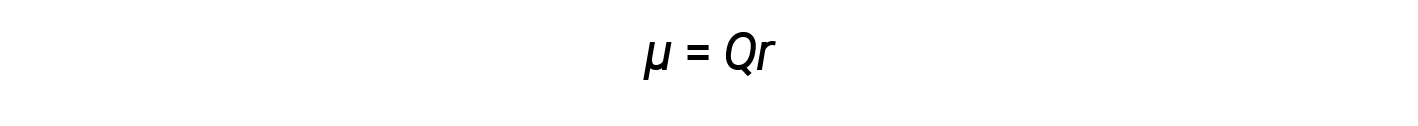
이 본드 모멘트는 방향과 크기를 모두 갖는 벡터, 수량으로 나타낼 수 있습니다. 디폴 벡터는 더 많은 전기 음의 원자를 향해 덜 전기 음의 원자에서 결합과 함께 가리키는 화살표로 표시됩니다. 작은 플러스 기호는 결합의 부분적으로 긍정적 인 끝을 나타내기 위해 덜 전기 음의 끝에 그려집니다. 화살표의 길이는 두 원자 사이의 전기적 차이의 크기에 비례한다.
전체 분자는 또한 그것의 분자 구조 및 그것의 결합의 각각의 극성에 따라서 전하의 분리가 있을 수 있습니다. 이러한 전하 분리가 존재하는 경우, 분자는 극성 분자 (또는 이폴)라고합니다. 그렇지 않으면, 분자는 비 극성이라고합니다. 이폴 모멘트는 분자 전체의 순 전하 분리 정도를 측정합니다. 이폴 모멘트는 분자 구조를 고려하여 3차원 공간에 본드 모멘트 모멘트를 추가하여 결정됩니다.
다원자 분자의 경우, 하나의 결합이 있기 때문에 결합 이폴 순간이 분자 극성을 결정합니다. Br2 및 N2와 같은 호모핵 해부학 분자는 전기성에서 차이가 없으므로 이폴 모멘트는 0입니다. CO와 같은 이종핵 분자의 경우 작은 이폴 순간이 있습니다. HF의 경우, 전기성에서 더 큰 차이가 있기 때문에 더 큰 이폴 순간이 있습니다.
분자에 두 개 이상의 결합이 포함되어 있는 경우 형상을 고려해야 합니다. 분자의 결합이 배열되어 결합 모멘트 취소(벡터 합계가 0과 같음)인 경우 분자는 극적이지 않습니다. 이것은 CO2의상황입니다. 각 결합은 극성이지만 분자 전체가 극성입니다. 루이스 구조에서, 그리고 VSEPR 이론을 사용하여,CO2 분자는 탄소 원자의 반대편에 극성 C=O 결합으로 선형으로 결정된다. 채권 모멘트는 반대 방향으로 가리키기 때문에 취소됩니다. 물 분자의 경우, 루이스 구조는 다시 중앙 원자에 두 개의 결합이 있음을 보여주고, 전기성 차이는 다시 이러한 결합의 각각이 제로 채권 순간을 가지고 있음을 보여줍니다. 그러나 이 경우, 분자 구조는 O의 고독한 쌍으로 인해 구부러져 있으며, 두 본드 모멘트는 취소되지 않는다. 따라서, 물은 그물 이폴 모멘트가 있고 극성 분자(이폴)이다.
이 텍스트는 오픈 탁스, 화학 2e, 제 7.2 장에서 적응: 공유 결합 및 오픈 세금, 화학 2e, 장 7.6 분자 구조와 극성.
