9.8:
Polaridade de Ligações, Momento Dipolar, e Caráter Iônico Percentual
9.8:
Polaridade de Ligações, Momento Dipolar, e Caráter Iônico Percentual
Polaridade de Ligações
O valor absoluto da diferença na eletronegatividade (ΔEN) de dois átomos ligados fornece uma medida aproximada da polaridade a ser esperada na ligação e, assim, o tipo de ligação. Quando a diferença é muito pequena ou zero, a ligação é covalente e não polar. Quando é grande, a ligação é covalente polar ou iónica. Os valores absolutos das diferenças da eletronegatividade entre os átomos nas ligações H–H, H–Cl, e Na–Cl são 0 (não polar), 0,9 (covalente polar), e 2,1 (iónica), respectivamente.
O grau em que os eletrões são partilhados entre átomos varia entre ser completamente igual (ligação covalente pura) a não o ser de todo (ligação iónica).
- Por exemplo, os átomos de H e F em HF têm uma diferença de eletronegatividade de 1,9, e os átomos de N e H em NH3 uma diferença de 0,9, mas ambos formam ligações que são consideradas covalentes polares.
- Da mesma forma, os átomos de Na e Cl em NaCl têm uma diferença de eletronegatividade de 2,1, e os átomos de Mn e I em MnI2 têm uma diferença de 1,0, mas ambas as substâncias formam compostos iónicos.
O melhor guia para o carácter covalente ou iónico de uma ligação é considerar os tipos de átomos envolvidos e as suas posições relativas na tabela periódica.
- As ligações entre dois não-metais são geralmente covalentes.
- As ligações entre um metal e um não-metal é frequentemente iónica.
Alguns compostos contêm ligações covalentes e iónicas. Os átomos em iões poliatómicos, tais como OH–, NO3−, e NH4+, são mantidos juntos por ligações polares covalentes. No entanto, estes iões poliatómicos formam compostos iónicos combinando-se com iões de carga oposta. Por exemplo, o nitrato de potássio, KNO3, contém o catião K+ e o anião poliatómico NO3−. Assim, as ligações no nitrato de potássio são iónicas, resultantes da atração eletrostática entre os iões K+ e NO3−, bem como covalentes entre os átomos de nitrogénio e oxigénio em NO3−.
Polaridade Molecular e Momento Dipolar
Como discutido anteriormente, as ligações covalentes polares ligam dois átomos com diferentes eletronegatividades, deixando um átomo com carga positiva parcial (δ+) e o outro átomo com carga negativa parcial (δ–), à medida que os eletrões são puxados para o átomo mais eletronegativo. Esta separação de carga dá origem a um momento dipolar de ligação. A magnitude de um momento dipolar de ligação é representada pela letra grega mu (µ) e é dada pela fórmula aqui apresentada, onde Q é a magnitude das cargas parciais (determinada pela diferença de eletronegatividade) e r é a distância entre as cargas:
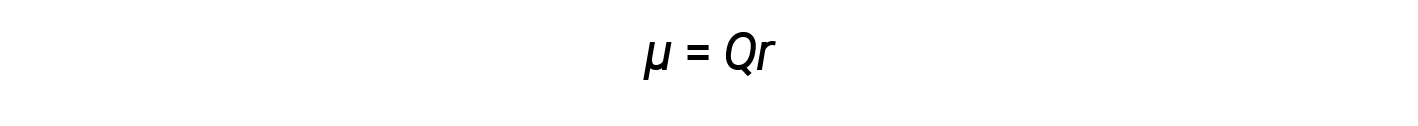
Esse momento de ligação pode ser representado como um vector, uma quantidade que tem tanto direção como magnitude. Os vectores dipolares são mostrados como setas a apontar ao longo da ligação do átomo menos eletronegativo para o átomo mais eletronegativo. Um pequeno sinal de mais é desenhado na extremidade menos elétrica para indicar a extremidade parcialmente positiva da ligação. O comprimento da seta é proporcional à magnitude da diferença da eletronegatividade entre os dois átomos.
Uma molécula inteira pode também ter uma separação de carga, dependendo da sua estrutura molecular e da polaridade de cada ligação. Se tal separação de carga existir, diz-se que a molécula é uma molécula polar (ou dipolar); caso contrário, diz-se que a molécula é não-polar. O momento dipolar mede a extensão da separação de carga líquida na molécula como um todo. O momento dipolar é determinado pela adição dos momentos de ligação no espaço tridimensional, levando em conta a estrutura molecular.
Para moléculas diatómicas, há apenas uma ligação, portanto, o momento dipolar de ligação determina a polaridade molecular. Moléculas diatómicas homonucleares, como Br2 e N2, não têm diferença na eletronegatividade, portanto o seu momento dipolar é zero. Para moléculas heteronucleares como CO, há um pequeno momento dipolar. Para HF, há um maior momento dipolar porque há uma maior diferença na eletronegatividade.
Quando uma molécula contém mais do que uma ligação, a geometria tem de ser tida em conta. Se as ligações em uma molécula estão dispostas de tal forma que os seus momentos de ligação se cancelam (soma de vector igual a zero), então a molécula é não-polar. Esta é a situação do CO2. Cada ligação é polar, mas a molécula como um todo é não-polar. A partir da estrutura de Lewis, e usando a teoria VSEPR, a molécula de CO2 é determinada como linear com ligações C polares em lados opostos do átomo de carbono. Os momentos de ligação cancelam porque estão apontados em direções opostas. No caso da molécula de água, a estrutura de Lewis mostra novamente que existem duas ligações para um átomo central, e a diferença da eletronegatividade mostra novamente que cada ligação tem um momento de ligação diferente de zero. Neste caso, no entanto, a estrutura molecular está dobrada por causa dos pares solitários em O, e os dois momentos de ligação não cancelam. Portanto, a água tem um momento dipolar líquido e é uma molécula polar (dipolar).
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 7.2: Covalent Bonding e Openstax, Chemistry 2e, Chapter 7.6 Molecular Structure and Polarity.
