11.9:
クラウジウス-クライペイロン方程式
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Clausius-Clapeyron Equation
Recall that the vapor pressure of a liquid increases with a rise in temperature. However, this dependence is not linear. To illustrate, the vapor pressure of water at 50 °C is 0.122 atm, while at 100 °C, it is 1 atm. Vapor pressure curves sharply upward with increasing temperature, resulting in an exponential curve. In comparison, when the natural log of vapor pressure is plotted against reciprocal temperature, a straight line is obtained, and its equation is called the Clausius–Clapeyron equation. Here, R is the ideal gas constant; c, a constant characteristic of the liquid, is the y-intercept; and the slope of the line is equal to the negative of the molar heat of vaporization over the gas constant. The equation allows the calculation of the molar heat of vaporization from the experimental measurements of equilibrium vapor pressures and temperatures. For example, suppose the natural log of ethanol vapor pressure plotted as a function of reciprocal temperature gives a straight line with the slope of negative 4638 kelvins. The equation for the slope of the line, along with the value of R, gives the molar heat of vaporization of ethanol as 38 560 joules per mole. If the molar heat of vaporization of any liquid and its vapor pressure at one temperature are known, the equation’s two-point form can be used to calculate the liquid’s vapor pressure at a different temperature. Take the example of water, whose enthalpy of vaporization is 40.7 kilojoules per mole. If the vapor pressure of water at 373 kelvins is 1 atm, what will be its vapor pressure at 383 kelvins? To solve, use the two-point form of the equation and substitute the given values of vapor pressure, enthalpy of vaporization, the two temperatures, and the gas constant to get the vapor pressure of water at 383 kelvins as 1.409 atm. The rise in vapor pressure from 373 kelvins to 383 kelvins is 0.409 atm, which clearly indicates that an increase in vapor pressure as a function of temperature is a non-linear process.
11.9:
クラウジウス-クライペイロン方程式
液体とその蒸気の平衡は、系の温度に依存し、温度が上昇すると液体の蒸気圧も上昇します。クラウジウス・クラペイロン方程式は、物質の蒸気圧(P)と温度(T)の定量的な関係を示したもので、単位温度の上昇に伴う蒸気圧の上昇率を予測するものです。
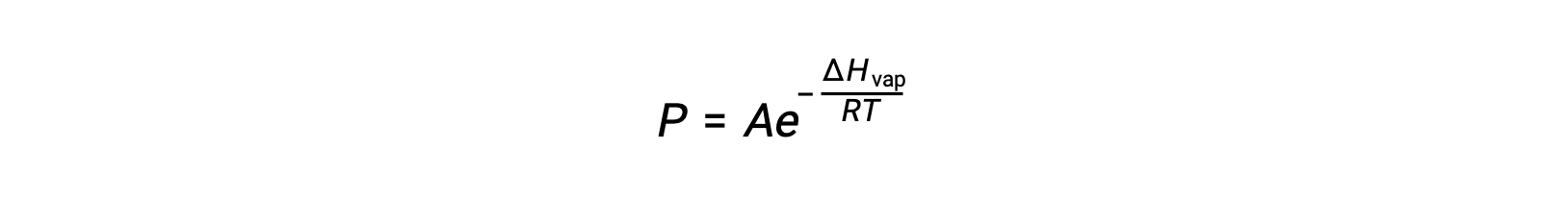
ここで、 ΔHvapは液体の気化エンタルピー、Rは気体定数、Aは物質の化学的性質に依存する定数です。この式では、温度(T)はケルビン単位でなければなりません。ただし、蒸気圧と温度の関係は直線的ではないので、この式を対数に直して一次式にすることが多いです。
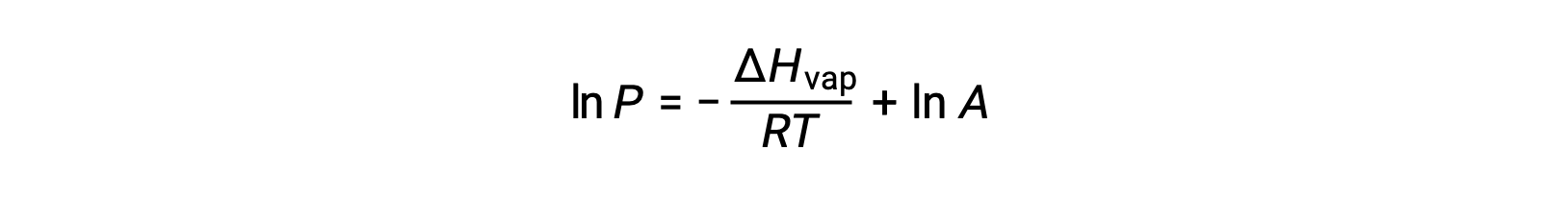
どのような液体であっても、特定の温度における気化エンタルピーと蒸気圧がわかっていれば、クラウジウス-クラペイロン方程式によって、異なる温度における液体の蒸気圧を求めることができます。そのためには、この一次方程式を2点式で表します。温度T1での蒸気圧がP1で、温度T2での蒸気圧がP2の場合、対応する一次方程式は:
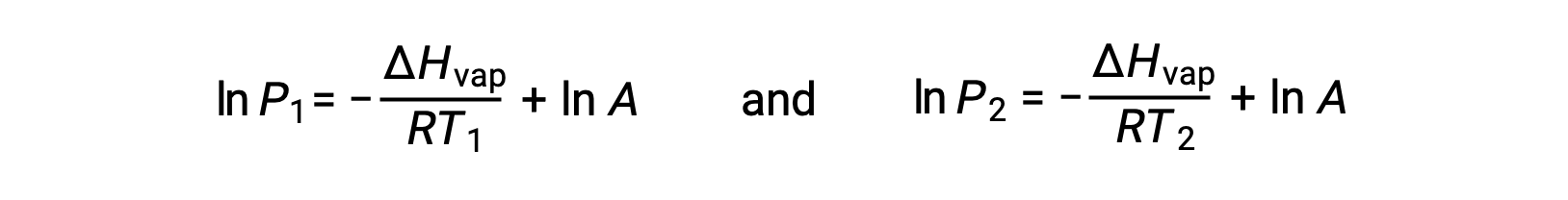
定数Aは同じなので、この2つの式を並べ替えてln Aを分離し、互いに等しくなるように設定することができます。
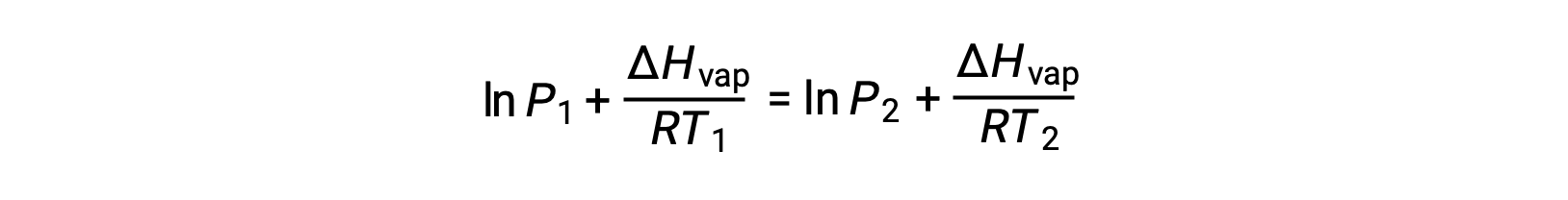
次のように組み合わせることができます。
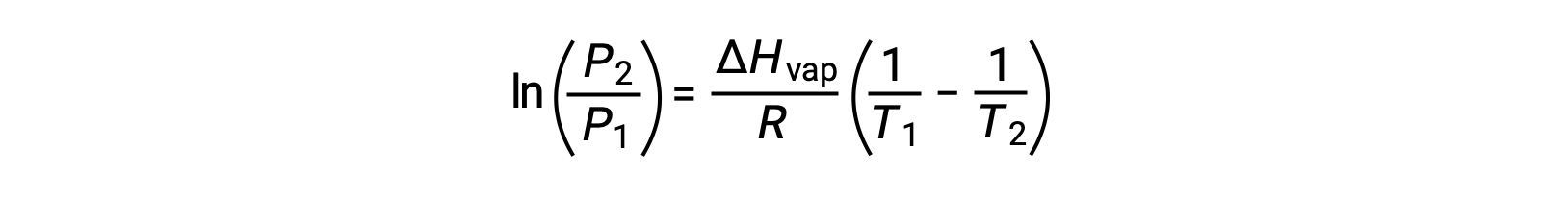
このテキストは、 Openstax 、 Chemistry 2e 、 Section 10.3 : Phase Transitions から引用しています。
