11.9:
Équation de Clausius-Clapeyron
11.9:
Équation de Clausius-Clapeyron
L’équilibre entre un liquide et sa vapeur dépend de la température du système ; une augmentation de la température provoque une augmentation correspondante de la pression de vapeur de son liquide. L’équation de Clausius-Clapeyron donne la relation quantitative entre la pression de vapeur (P) d’une substance et sa température (T) ; elle prédit la vitesse à laquelle la pression de vapeur augmente par unité d’augmentation de la température.
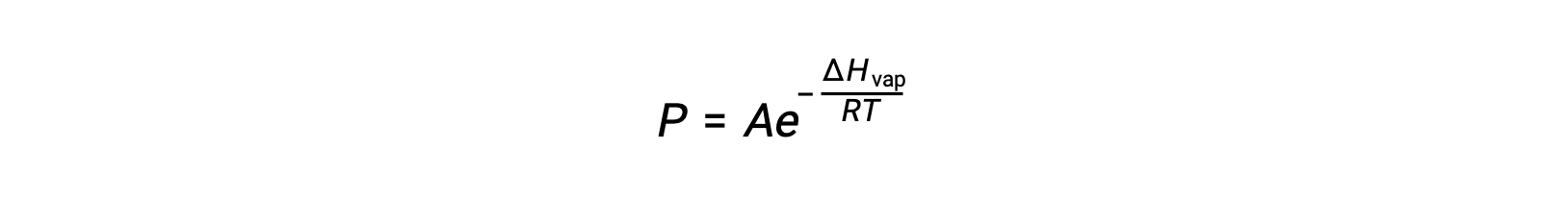
Où ΔHvap est l’enthalpie de vaporisation du liquide, R est la constante des gaz et A est une constante dont la valeur dépend de l’identité chimique de la substance. La température (T) doit être en Kelvin dans cette équation. Cependant, comme la relation entre la pression de vapeur et la température n’est pas linéaire, l’équation est souvent réorganisée sous forme logarithmique pour produire l’équation linéaire :
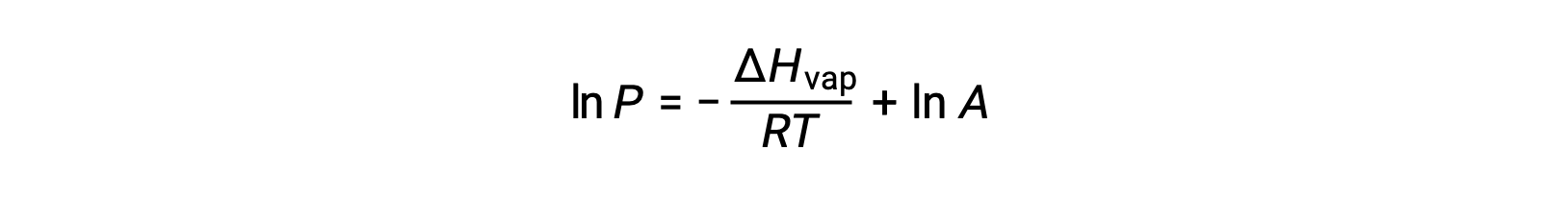
Pour tout liquide, si l’enthalpie de vaporisation et la pression de vapeur à une température particulière est connue, l’équation de Clausius-Clapeyron permet de déterminer la pression de vapeur du liquide à une température différente. Pour ce faire, l’équation linéaire peut être exprimée dans un format à deux points. Si à la température T1, la pression de vapeur est P1 et si à la température T2, la pression de vapeur est P2, les équations linéaires correspondantes sont :
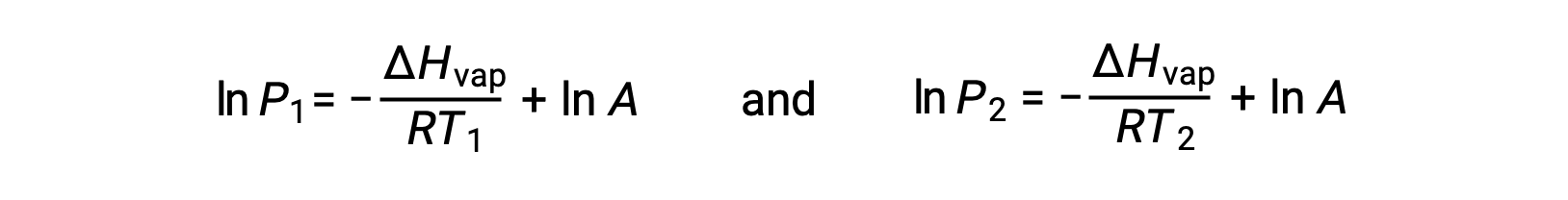
Puisque la constante, A, est la même, ces deux équations peuvent être réorganisées pour isoler ln A et les définir comme étant égales l’une à l’autre :
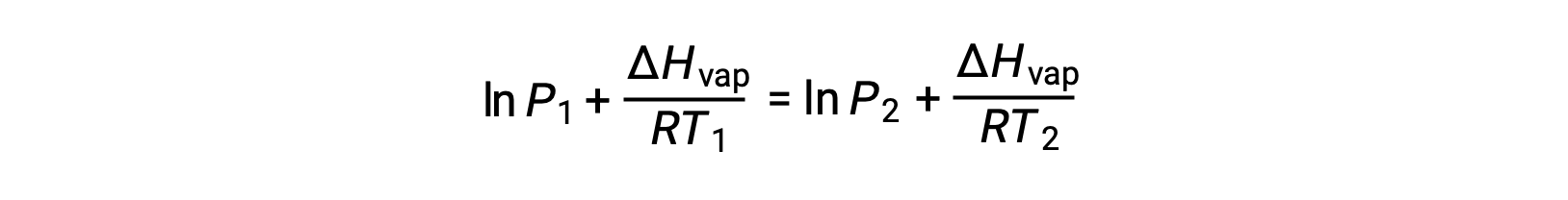
qui peuvent être combinées en :
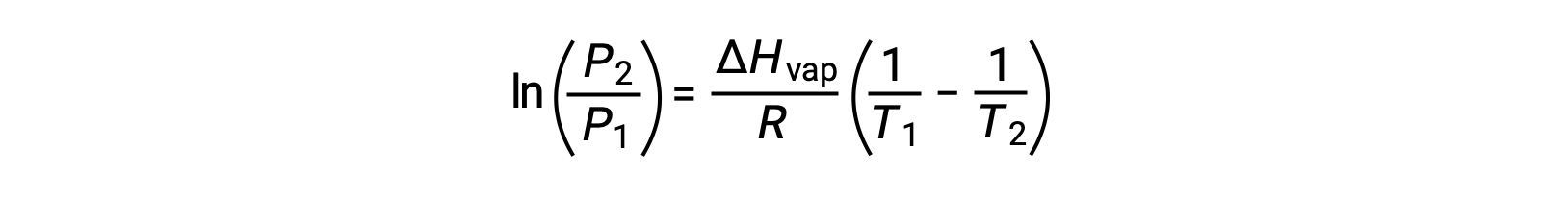
Ce texte est adapté de Openstax, Chimie 2e, Section 10.3 : Transitions de phases.
