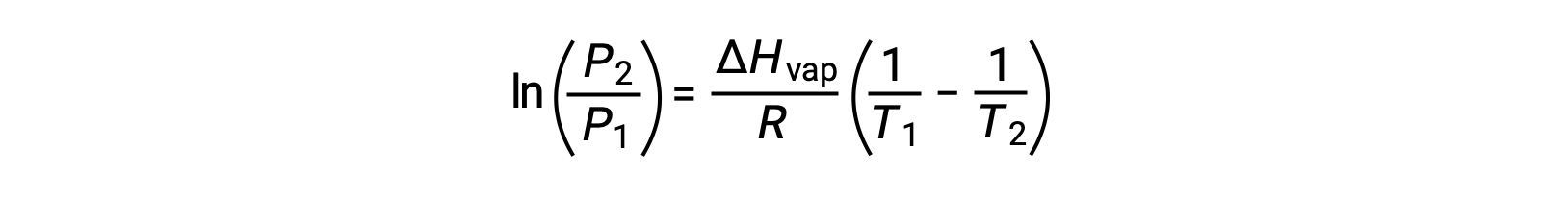11.9:
클라우지우스-클라페롱 식
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Clausius-Clapeyron Equation
온도가 상승하면 액체의 증기 압력이 증가한다는 점을 기억하십시오. 그러나 이 종속성은 선형적이지 않습니다. 예를 들어 섭씨 50도에서 물의 증기압은 0.122 atm인 반면 섭씨 100도에서는 1 atm입니다.증기 압력은 온도가 증가함에 따라 급격히 상승하여 지수 곡선을 생성합니다. 이와 비교하면 증기압의 상호 온도에 대한 자연 로그를 그리면 직선이 얻어지는 데 그 방정식을 클라우지우스-클라페롱 방정식이라고 합니다. 여기서 R은 이상적인 기체 상수이고 액체의 특정적인 상수인 c는 y 절편이며 선의 기울기는 기체 상수에 대한 기화 몰 열의 음수와 같습니다.이 방정식을 사용하여 평형 증기 압력 및 온도의 실험 측정 결과로부터 기화의 몰 열을 계산할 수 있습니다. 예를 들어 상호 온도의 함수로 표시된 에탄올 증기 압력의 자연 로그가 기울기가 음의 4638 켈빈인 직선으로 된다고 가정합니다. R 값과 선의 기울기에 대한 방정식을 풀면 에탄올의 기화 몰 열은 몰당 38560줄입니다.만약 어떤 액체의 기화의 몰 열과 그것의 한 온도에서의 증기압 값이 알려진다면 방정식을 사용하여 서로 다른 온도에서 액체의 증기압을 계산할 수 있습니다. 엔탈피가 몰당 40.7킬로줄인 물을 생각해봅시다. 373 켈빈에서 물의 증기압이 1 atm이라면 383 켈빈에서 물의 증기압은 얼마나 될까요?문제를 풀려면 방정식의 2점 형태를 사용하고 주어진 증기 압력, 기화의 엔탈피, 두 온도, 가스 상수의 값을 대입하여 383 켈빈에서 물의 증기압력 1.409 atm을 얻습니다. 373 켈빈에서 383 켈빈으로 증기압의 상승은 0.409 atm 이며 이는 온도 함수로써의 증기압의 증가가 비선형 과정임을 분명히 나타냅니다.
11.9:
클라우지우스-클라페롱 식
액체와 증기 사이의 평형은 시스템의 온도에 따라 달라집니다. 온도의 상승은 액체의 증기 압력에 대응하는 상승을 야기한다. 클라우스-클랩페이론 방정식은 물질의 증기압력(P)과온도(T)사이의 정량적 관계를 제공합니다. 단위당 증기 압력이 증가하는 온도가 예측됩니다.
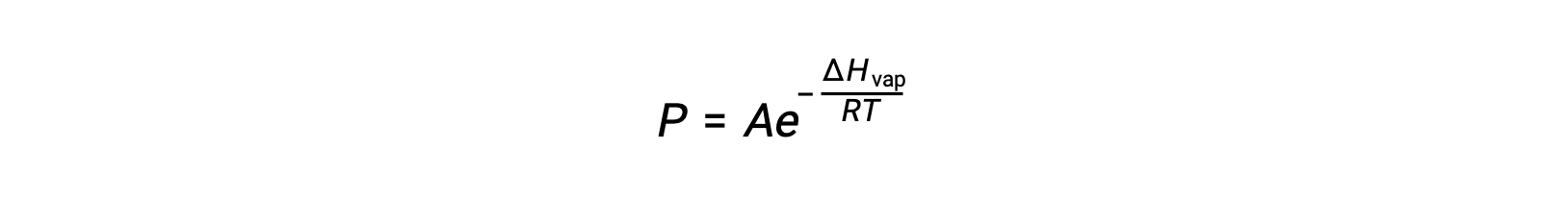
ΔH증기가 액체에 대한 기화의 엔탈피인 경우, R은 가스 상수이며, A는 물질의 화학적 정체성에 따라 값이 일정한 다. 온도(T)는이방정식에서 켈빈에 있어야합니다. 그러나 증기 압력과 온도 간의 관계가 선형이 아니기 때문에 방정식은 선형 방정식을 산출하기 위해 로그리지믹 형태로 재배열되는 경우가 많습니다.
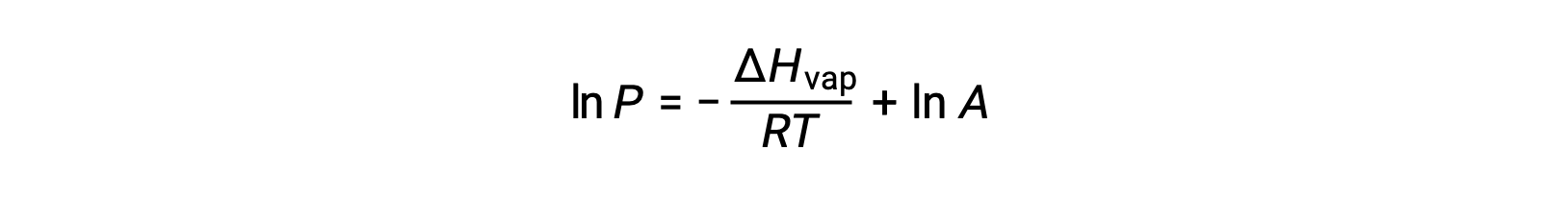
어떤 액체의 경우, 특정 온도에서 기화 및 증기 압력의 엔탈피가 알려지면 클라우시우스-클랩페이론 방정식은 다른 온도에서 액체의 증기 압력을 결정할 수 있게 한다. 이렇게 하려면 선형 방정식이 2점 형식으로 표현될 수 있습니다. 온도 T1에서증기 압력은 P1이고온도 T2에서증기 압력은 P2이며,해당 선형 방정식은 다음과 같습니다.
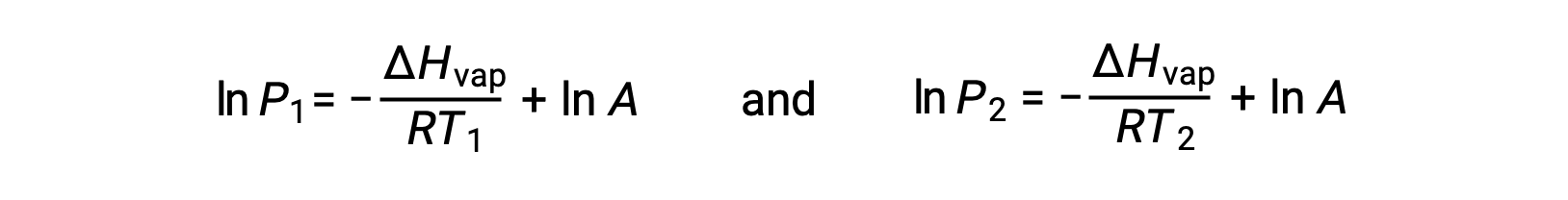
상수 A는동일하므로 이 두 방정식은 ln A를 격리한 다음 서로 동일하게 설정하도록 재배열될 수 있습니다.
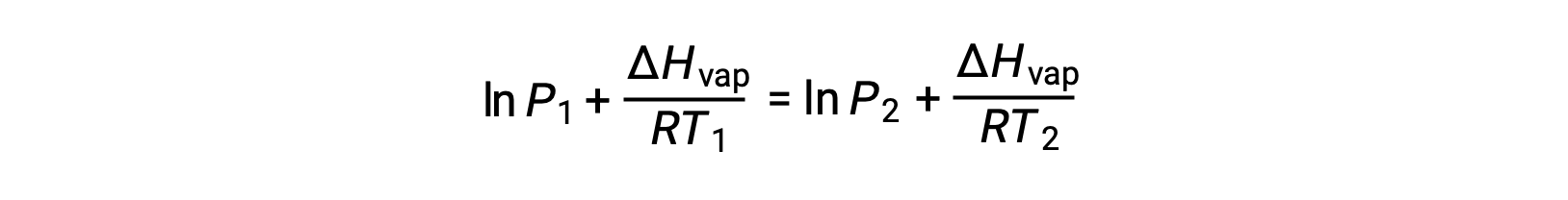
결합할 수 있는 것: